医学监查(Medical Monitor,MM)最初是由美国国立卫生研究院(National Institutes of Health,NIH)提出并实施,旨在提升数据质量和实施效率后来被美国以及欧洲多个大型制药企业所借鉴,并在21世纪初由外资企业首次引进至我国,这个行业也在过去的十年中迎来了一个高速发展期。
2020年国家药监局发布了《药物临床试验质量管理规范》,其中对监查的定义是这样的:即指监督临床试验的进展,并保证临床试验按照试验方案、标准操作规程和相关法律法规要求实施、记录和报告的行动。申办方需要定制临床试验监查计划,计划中需要制定监查策略、方法、职责、途径、手段和要求(包括频率、间隔等)。
长久以来,临床监查员(CRA)的现场监查对临床试验的质量绩效发挥着至关重要的作用,研究者、机构、伦理委员会也越来越依赖于CRA的现场“督促”和“帮助”,CRA也逐渐开始承担了很多与监查无关的工作,这对对企业来说也增加了很多人员上的隐形成本。为降低日趋增长的监查成本,近些年来美国FDA、欧盟EMA也推行了一系列的用于降低人工监查的指导建议和监查策略。
CTTI(Clinical Trials Transformation Initiative)即作为美国杜克大学与美国食品药品监督管理局(FDA)于2007年合作成立的一个公私合作机构,其使命是开发和推动临床实践的变革,致力于提高临床试验的质量和效率。并在这个方面作出了很多贡献,相关指导建议为很多国内外头部药企和CRO公司所借鉴采纳。但实际上从FDA到NMPA(国家药品监督管理局)至今也没有发布过相关的法规、指南具体说明MM工作的必要性和作用。那么MM到底是做什么的呢?
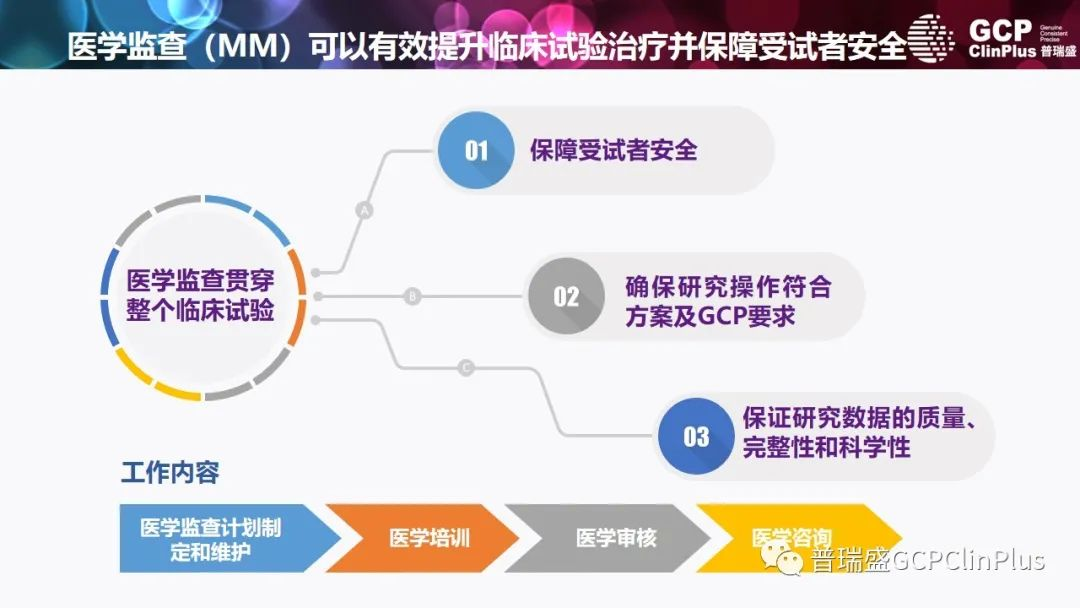
MM在临床研究策划、实施及质量保证体系建设上正在发挥重要的作用,在整个临床试验提供医学专业知识和监督。临床试验中的职责是保护受试者安全,并提供独立监管以确保临床试验过程科学可靠、临床数据真实完整。医学监查员(MM)不同于临床监查员,是具有适当资格的医学人员,为与临床试验有关的医学问题提供管理和咨询,也为研究中心和研究团队提供专业医学观点。在临床试验中主要职责是监督研究受试者的安全性和保护,并提供独立的监管以帮助确保临床试验过程的科学可靠性、临床数据完整性和质量。MM的参与对于试验能够遵守GCP指南极为重要,并且MM在多中心临床试验中几乎总起着重要作用。
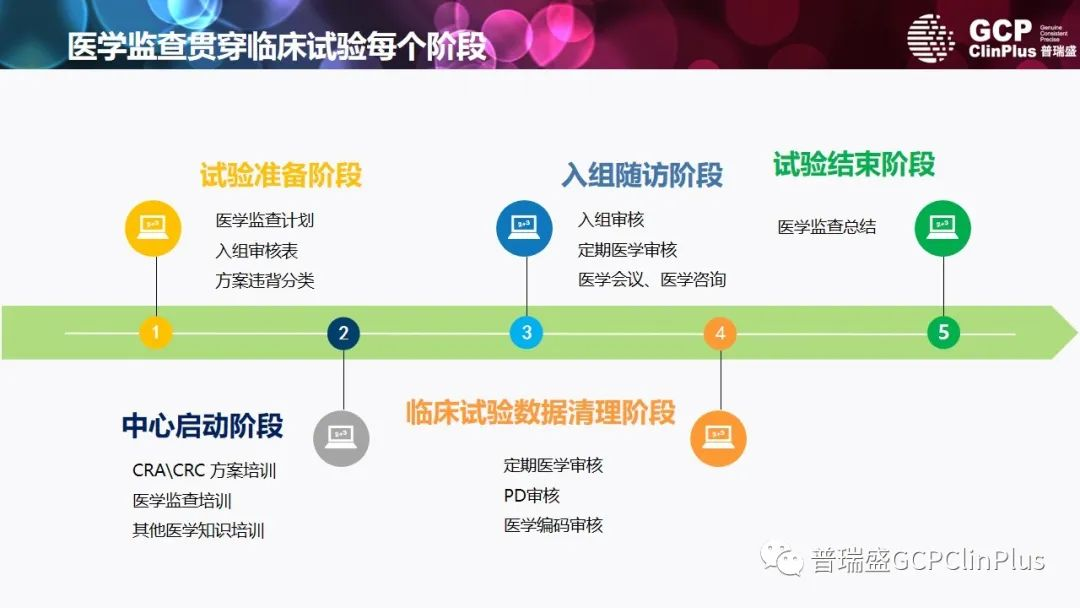
政策法规不断推陈出新,提高临床研究质量大势所趋。MM是临床研究策划、运行、实施及质量保证体系的重要组成,在国际上已运行规范、日趋成熟,但尚未引起我国新药研发企业的足够重视和有效管理。在各个阶段的临床研究的运行过程中,可能遇到各种各样的问题。
例如:研究者可能并不熟悉临床研究试验药相关的药理和药代特点,不能及时参考研究者手册,只了解所在中心受试者的情况,不了解既往试验药安全性信息,同时,部分安全性报告常常不完整,信息模棱两可,不符合逻辑,对于相关性的态度存在矛盾。
MM需要协调整个临床试验的进行,需要及时与研究者、伦理委员会、临床试验机构、临床研究协调员、临床研究团队等人员进行沟通;另一方面,如果临床方案的执行面临太多困难,与当初的设计不一致,MM还需要跟进解决,优化方案,满足科学性的需求。
MM人员的从业资格:
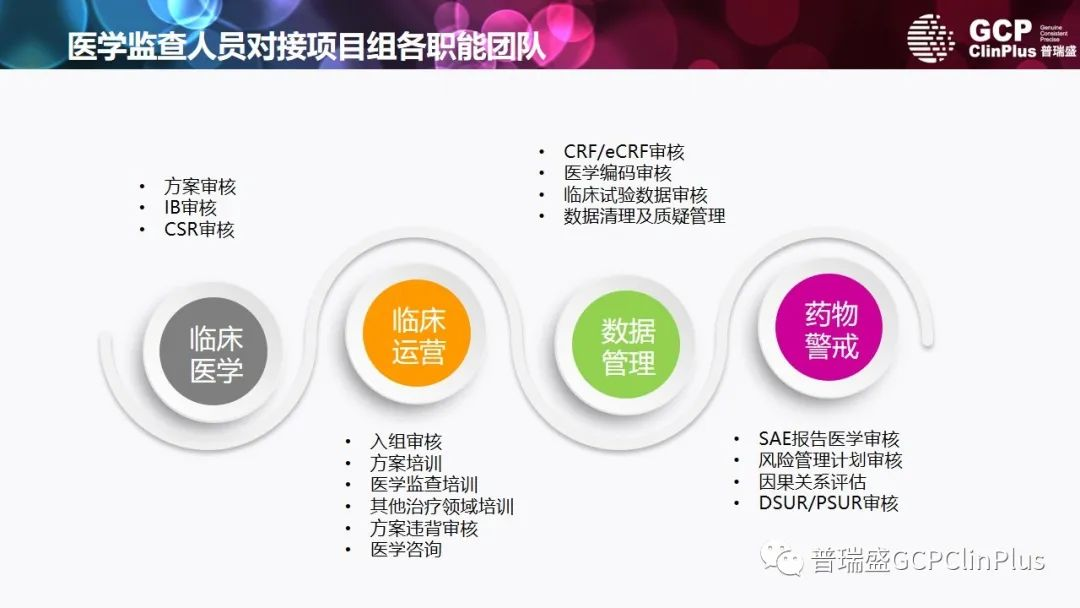
医学监查员(MM)不同于临床监查员,是具有适当资格的医学人员,因为MM日常需要回复临床试验中的各种问题,同时对每一位入组候选人是否符合入排标准进行审核,所以拥有一定年限的临床工作经验/背景、具有临床执业医师资料(取得一定职称)是从事该工作的先决条件。除此以外,因为MM需要对临床试验中的方案违背(PD)进行审核并给出预防措施的专业建议,所以在人员对临床试验方案的理解上也有更高的要求。
MM的我们所能提供的服务包括但不限于:
撰写医学监查计划(Medical Monitoring Plan,MMP);
临床方案及相关治疗领域培训;
为临床研究团队提供全程医学支持;
入选排除标准核查,以明确受试者具有入选资格;
方案违背(PD)审核,提出专业医学建议和解决方案,减少同样的PD再次发生;
临床数据的定期医学审核。
普瑞盛医药 | 医学监查团队优势
为确保临床项目执行的质量,医学监查团队时刻关注国内外相关法规、指南动向,定期对团队SOP进行优化并及时更新相关文档;
截至目前已经开展临床项目近100余项,项目涵盖Ⅰ~Ⅳ期,覆盖领域包含:肿瘤(实体瘤、血液瘤),新冠肺炎、内分泌,眼科,呼吸,风湿免疫;心血管,感染科,血液科,皮肤等。
行业中较为成熟的培训、管理流程和质量体系文件,规范日常工作的流程和要求,确保项目质量;
项目启动前团队成员即参与临床方案的审核、医学监查计划(MMP)的准备以及对项目组成员进行专业医学培训,试验过程中的医学监查(包括入排审核,方案偏离的审核,医学咨询,医学数据审核,临床数据清理以及医学支持等);
所有医学监查成员都拥有至少5年以上的临床工作经验,其中3年以上临床工作的超过40%,均拥有多年的医院临床工作经历和丰富的临床试验经验积累,MM核心成员保留率100%,团队流动率低于10%。