众所周知,临床试验中有着很多指导性小工具,本次要分享的就是实体瘤疗效评估标准(Response Evaluation Criteria in Solid Tumors, RECIST),这个小工具有着一定的发展历程,目前我们常用的是2009版RECIST1.1,其中1.1是它的版本号;那么,iRECIST又是什么呢?它们之间有什么区别呢?对于CRF的设计我们又需要分别考虑什么呢?带着这些问题我们继续往下看。
肿瘤临床试验
传统肿瘤治疗主要以影像学上肿块大小变化为评判标准,而随着RECIST1.1的实际运用,我们发现它在评估免疫疗法时出现一些误差:假性进展、混合缓解、延迟反应、疾病超进展等问题。因此RECIST1.1在免疫相关的疗效评价中不能准确反映疗效和生存获益情况,从而在2017年初,RECIST工作组正式提出了实体瘤免疫疗效评价标准(immune Response Evaluation Criteria in Solid Tumors, iRECIST),将可测量的新发病灶计入总肿瘤负荷中,并将其与基线肿瘤负荷进行比较,并提出未确认的疾病进展和确认的疾病进展的概念,从而为临床决策者提供一致性的参考。
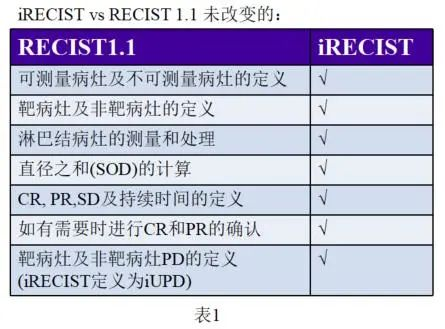
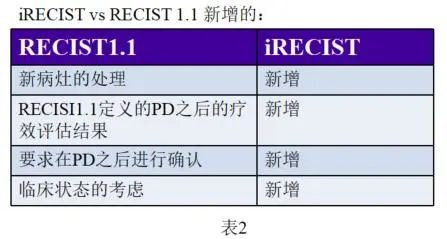
通过下面的表1和表2整理的共性与个性比对,我们来了解一下iRECIST相对于RECIST1.1未发生改变的以及新增的内容:
不难看出,RECIST1.1和iRECIST在大致的原则上还是一致的,只不过增加了一些免疫确证信息,那在实际使用过程中,这两个标准的区别是什么样的呢?请见下表3:
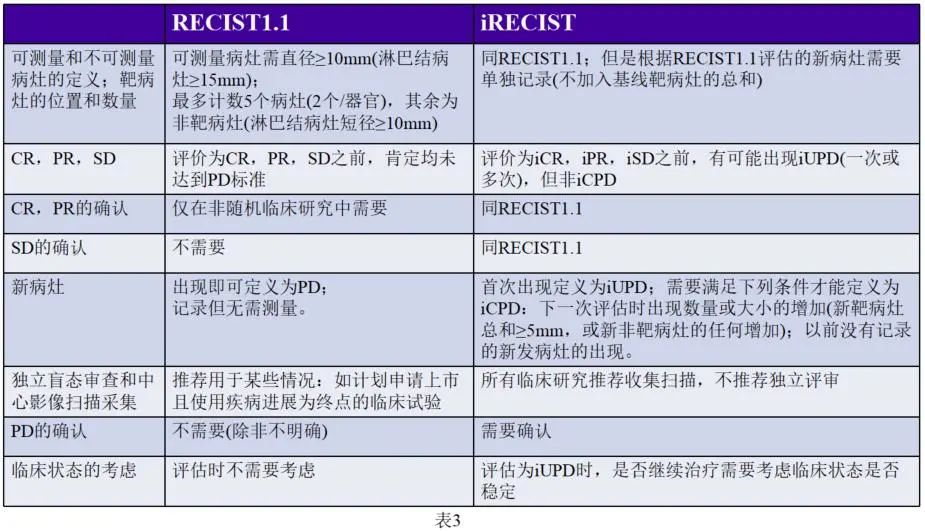
iRECIST的主要变化在于界定了肿瘤免疫治疗的延迟效应,在RECIST1.1标准的基础上首次提出了iUPD免疫未确认的疾病进展(immune unconfirmed progressive disease) 和 iCPD免疫确认的疾病进展 (immune confirmed progressive disease) 的概念。iRECIST评估在RECIST1.1首次PD时开始,如果受试者从未满足iUPD的标准,则遵循RECIST1.1进行评估;如果满足了iUPD,即在首次PD后,不再使用RECIST1.1进行评估。
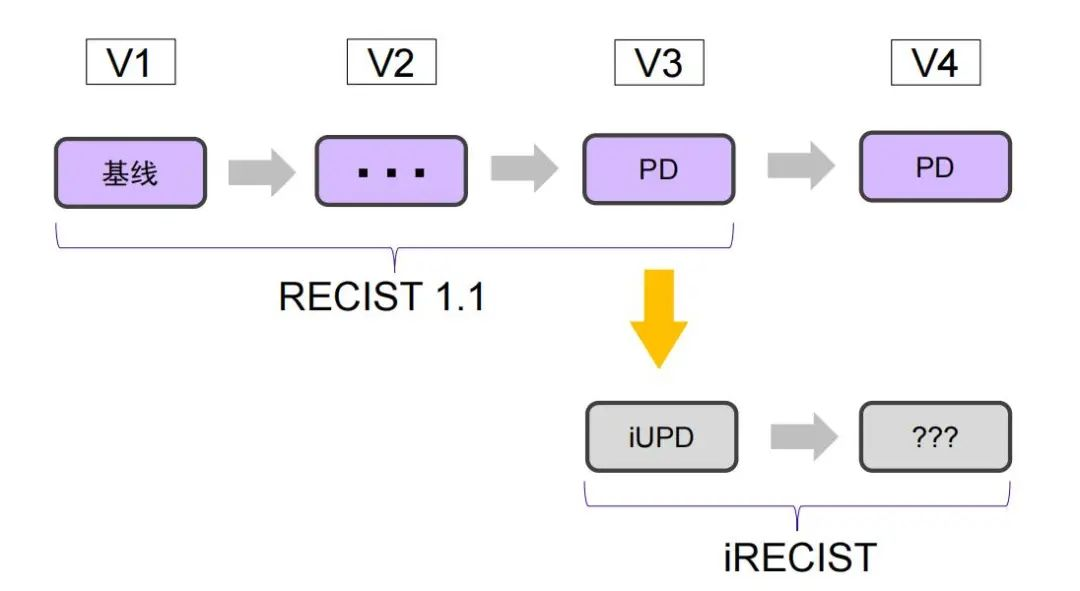
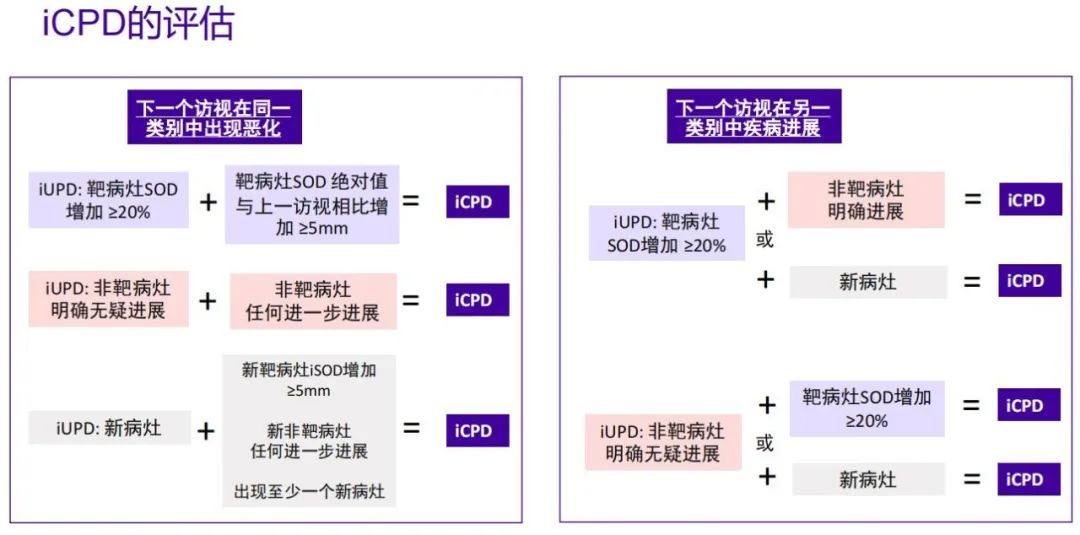
对于iUPD,后续评价方法做了充分阐述,建议患者首次iUPD 后,若患者临床状态稳定,继续治疗至下次评估后,若患者临床状态稳定,继续治疗至下次(4-8周)评估,以确保患者在此期间仍能接受到适合的挽救治疗。若后续治疗中疗效评价为iUPD的肿瘤没有发生变化,则下次评估仍为iUPD,直至获得确证的PD,即iCPD。对于新病灶的出现,RECIST标准直接定义为PD,不需要测量;而iRECIST标准初步定义为iUPD,并根据RECIST1.1原则将新病灶再次划分为新靶病灶和新非靶病灶,新靶和新非靶的评估与之前已存在的靶病灶/非靶病灶的评估作为平行关系,不纳入原始肿瘤负荷基线,再次评估时只要满足条件即可定义为iCPD。
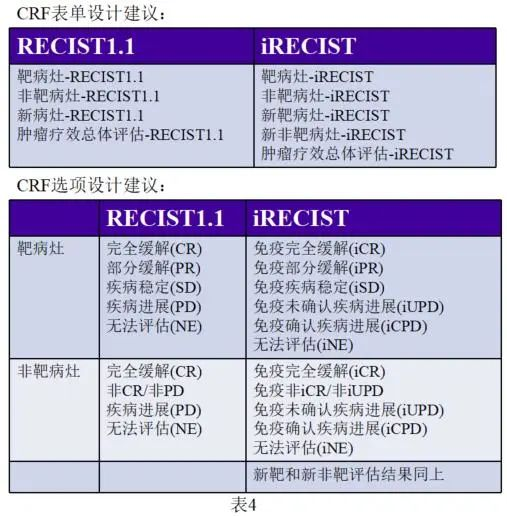
综合上述的讨论,很显然,如果在某个临床试验中综合使用RECIST1.1和iRECIST进行肿瘤疗效评估,则在CRF设计过程时需要考虑这两个标准的一致性和差异性。不难看出的是,各个肿瘤评估表单是建议按照RECIST1.1和iRECIST分开设计的;其次,对于引入了iRECIST评估标准的项目,不再单独设计新病灶页面,而是改为新靶病灶和新非靶病灶页面;再然后就是iRECIST疗效评估结果的设定,不仅在RECIST1.1评估结果的基础上加上“i”,还需要将PD变更为iUPD和iCPD两个选项。