2013年3月,国家食品药品监督管理局安监司发布《关于推动生产企业开展药品重点监测工作的通知(征求意见稿)》,旨在进一步贯彻落实《药品不良反应报告和监测管理办法》,推动药品生产企业开展药品重点监测工作。
聚焦
药品重点监测(IDM)是什么?
1 IDM:Intensive Drug Monitoring(药品强化监测)
2 2001年,药品不良反应知识问答:最早提到重点监测制度:处方事件监测 ( Prescription Event Monitoring,PEM)。
3 2011年,实施的新版管理办法在第四章“药品重点监测”:规定了重点监测的责任主体及其责任,还规定了省级以上药品监督管理部门、省级以上药品不良反应监测中心的责任。
Q 药品重点监测有哪些法规依据?
A
《关于推动生产企业开展药品重点监测工作的通知 (征求意见稿) 》
《生产企业药品重点监测工作指南》
《药品不良反应报告和监测管理规程》
聚焦重点监测 · 关注患者健康
法规对药品重点监测有哪些要求:
1/对于2011年7月1日及以后获得药品批准证明文件,且自本通知下发之日起处于新药监测期或首次进口五年内的药品,生产企业应当开展重点监测。
2/流程:省以上药监→通知企业→企业主动开展监测。
3/企业接到启动通知后60日内向药品不良反应中心监测中心报备重点监测方案。国产药品到省级报备,进口药品向国家局报备。
4/监测中心收到方案→15个工作日内反馈→调整方案后,生产企业在15个工作日内再报备。
5/企业接到启动通知后60日内向药品不良反应中心监测中心报备重点监测方案。国产药品到省级报备,进口药品向国家局报备。
监测中心收到方案15个工作日内反馈调整方案后,生产企业在15个工作日内再报备。
药品重点监测主要是观察上市后药品在广泛人群使用情况下的不良反应,那么具体内容包括哪些?
1/研究已知不良反应的发生率。
2/观察新的不良反应的发生情况。
3/研究靶向不良反应/事件的关联性、发生率、严重程度、风险因素等。
靶向不良反应/事件包括:此前研究发现的药品安全信号;严重ADR/SAE;同类产品存在的ADR/SAE;其他。
4/特殊人群
5/观察到药品使用,包装,质量相关安全性问题
药品重点监测人群的选择和要求有哪些?
1/监测人群设计
普通人群监测:常规选择;
特定人群监测:特定条件下,药监部门要求或许可采用,如老人、儿童、孕妇、肝肾功能损害患者、长期用药患者。
2/病例数量:
原则上纳入统计分析的病例数量不应少于3000例,罕见病、特殊病种的病例数量达不到3000例的,应收集监测期内或进口五年内的所有病例(不少于使用人数的80%)的信息。
3/信息收集
医疗机构(如医院、社区医疗服务机构)、药店、计生站、戒毒所等相关药品使用单位
医疗机构为主要渠道
4/说明
这与IV期有区别,IV期只能在医疗机构收集
医疗机构如何选择?依次按下列顺序
哨点医院
二级以上资质的医疗机构
药品使用的真实世界
信息如何采集
住院患者集中监测:用于住院患者
登记-回访:用于门诊,药店和特殊人群
问卷调查:用于门诊,药店和特殊人群
(长期慢病用药?可以用在住院中收集)
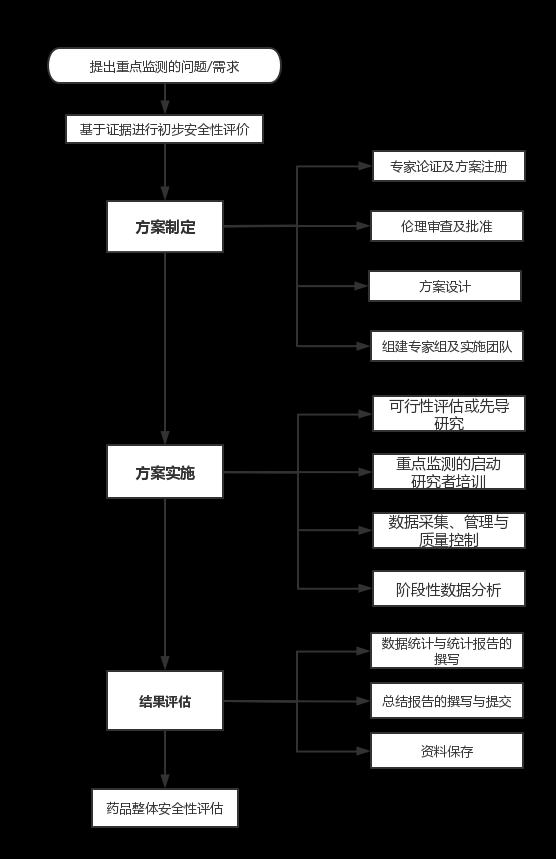
重点监测项目的方案设计
重点监测项目的方案与其他Ⅳ期临床研究类似
定义收集的数据集:避免冗余数据,不是越多越好,收集核心数据为主;
患者基本信息:人口学资料(年龄,性别,民族,身高,体重),入院时间,出院时间,过敏史,过敏性疾病史,个人不良嗜好(吸烟,饮酒等),疾病诊断和编码;
重点监测品种的使用信息:用药适应症,品种规格,用药剂量,给药途径,给药频率,合并用药。如果是注射剂,还应包括溶媒种类,剂量,药品配置后存放时间,给药速度,配伍用药等;
患者生命体征(体温,呼吸,脉搏,血压)
实验室指标:血常规,凝血功能,血生化等。主要关注与药物相关的指标;
不良反应/事件:详细记录;
报告类型、既往不良事件/反应、家族药品不良反应/事件、相关重要信息(吸烟,饮酒,妊娠,肝病史,肾病史,过敏等),怀疑药品,并用药品,不良反应/事件名称,其出现时间,发展过程,处理措施和转归,并进行关联性评价。
药品重点监测项目的一般流程