临床试验是什么?
每当别人问“你从事什么职业”?
我总是在思考该如何用最简单的话语去描述我所从事这份职业。
慢慢发觉,“临床试验”需要很长的篇幅去解释,不是寥寥几句可以描述清楚的。所以我决定用我并不出彩的文笔写下我的所学所想。2018年我作为CRA走进临床试验,三年的磕磕绊绊,用文字记录这些年的辛酸泪。
临床试验从开始到结束需要很长时间,大多数项目我们只接触到了临床试验的某一阶段,很少能完整的做完一个临床试验项目,so ,今天想聊聊我眼中的临床试验全流程。
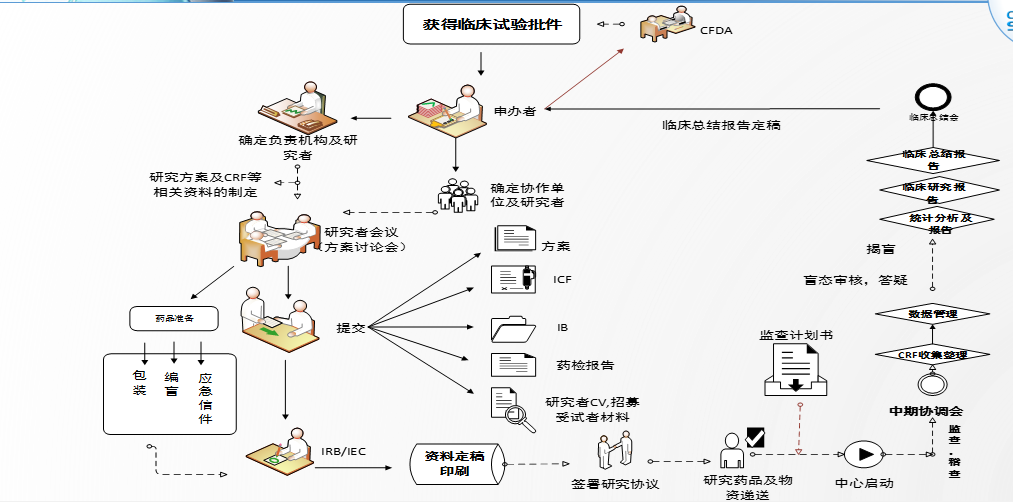
临床试验是一个完整的闭环,是以研究产品为起点,在人体进行药物的系统性研究,观察研究产品的有效性及安全性,流程复杂,期间涉及到众多角色,需要各方面人员配合才能顺利完成。经验有限,简单从几个关键点和大家谈一下自己的理解。
01 商务竞标
以CRO公司为例,在获取一个研究产品的基本信息后,医学部会根据申办方提供的研究产品资料撰写方案摘要,后续为调研人员(大多时候是CRA)进行方案的初步培训。
调研人员根据现有方案进行项目的调研(调研大概就是找到机构或研究者的联系方式,基于方案去收集医院信息),与Site沟通并获取充分的调研信息后,医学部及商务部会整合资料进行商务竞标。
竞标成功后签署协议,这个项目就可以由该CRO公司去执行。申办方会与CRO公司进行项目交接,CRO公司内部还会与执行部门的相关人员进行一次内部交接,确定具体的执行团队。这时候可以同步进行方案、IB、ICF等文件的起草。
02 中心筛查
执行部门接到项目后,第一时间建立项目研究团队,制定项目管理计划。CRA会进行中心可行性调研和中心评估,选择愿意参加及有能力、有资质执行该项目的医院相关科室参与该试验。
中心筛选阶段一般是先确定组长单位,然后请组长单位PI推荐Site。医院方面建议先与机构沟通PI人选, 从机构方获取PI联系方式,以免先与PI沟通确定后,与机构的计划PI人员违背,造成不必要的麻烦,影响项目的后期执行。
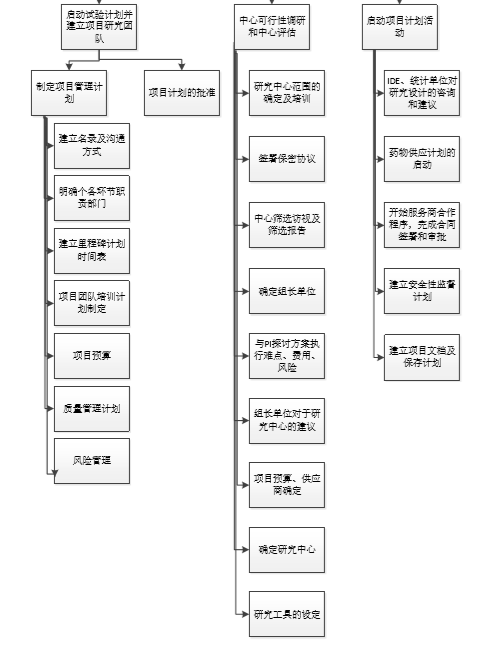
03 研究者会议-核心文件定稿
所有参加临床试验的Site(研究中心数量不固定,参考申办方、组长单位PI意见和项目要求)及PI(主要研究者)确定后,则可以准备研究者会议。该会议是试验所有site人员参加,共同讨论项目如何执行并确定方案入排标准的会议。研究者会议是研究者最积极配合的阶段(友情提示:这个时候比较容易和研究者建立良好关系)。会议一般由组长单位PI主持,参会人员包括:各中心研究者、机构老师、申办方人员、CRO人员、统计、数据等人员。
在研究者会议上临床试验方案会达成共识,其他核心文件如知情同意书会后也会基本定稿。
试验涉及遗传办,则可以开始准备递交遗传办的资料。
04 伦理批件获取
核心文件定稿后,CRA可以开始准备研究中心的立项资料(医院临床试验机构)及伦理资料(医院临床试验伦理委员会)。根据每个中心立项清单及伦理清单准备资料,需要按中心要求装订递交。大部分中心需要组长单位的伦理批件,大部分情况是组长单位批件拿到后,其他中心才能递交资料,但除组长单位批件外的其他资料可以提前准备~
立项:资料无误,机构审核确定后即立项成功并获取立项号;个别研究中心机构会要求召开立项审核会,即立项资料也进行会议审查,具体的立项要求参考研究中心的要求。
伦理:大多数中心,立项通过后可以进行伦理资料的递交,由CRA与伦理秘书进行沟通(或者按医院官网要求),获取伦理资料递交要求,递交伦理资料;个别中心是立项资料与伦理资料为一套资料,只需递交一份到机构即可,机构审核后立项,再递到伦理,不需要CRA单独与伦理沟通进行递交。
伦理资料递交成功后,伦理费用按照Site要求支付。做好伦理审查PPT,等待伦理审查会议。会议后一般一周左右可以收到伦理审查意见,若伦理审查意见为同意即可进行合同的沟通;如果伦理审查有意见提出,按审查意见修改后递交更新后的文件再次进行伦理审核(一般快审,部分改动过大的会审)。拿到批件可以进行合同的签署啦~
PS:立项资料与伦理资料尽可能的同时收集清单与要求,文件同步盖章则项目进度会加快些,除非是必须在立项后才能给到伦理递交要求的Site。
清单和要求,可以参考这几个方式获取:
医院官网查询;
wetrial和药试圈等医院常用系统网站;
机构伦理沟通获取;
已经确定好CRC的中心,CRC熟悉医院会比较清楚流程;
药研社等软件或者公众号;
中心一般会有CRA的群,可以求得想要的资料及要求。
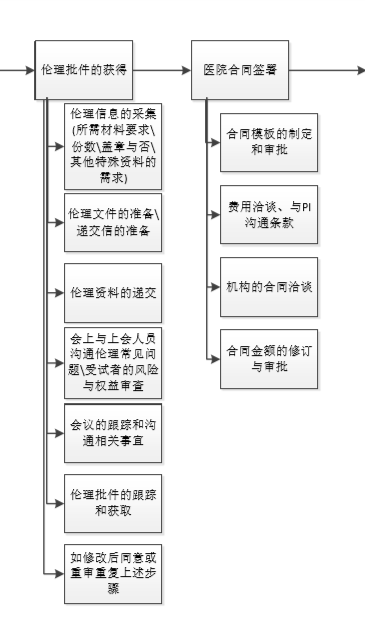
05 临床试验协议沟通及签署
与医院的临床试验协议在拿到批件后进行签署。协议的模板根据中心要求制定,建议用site的模板,会比较快通过审核;协议的沟通可以在伦理批件获取前与机构及PI进行沟通,协议可以开始沟通的节点看机构的要求。协议一般需要多轮修改,因此提前沟通可以节省时间,推进项目进度。一般合同沟通签署需要一个月的时间。
如果试验涉及遗传办,可以在获取伦理批件后按照中心要求提交文件(要求可以提前获取,中心承诺书签盖所需的文件提前准备,承诺书盖章不一定在伦理批件获取后,看site具体要求),获取承诺书签盖件后,按遗传办要求进行遗传办的备案。
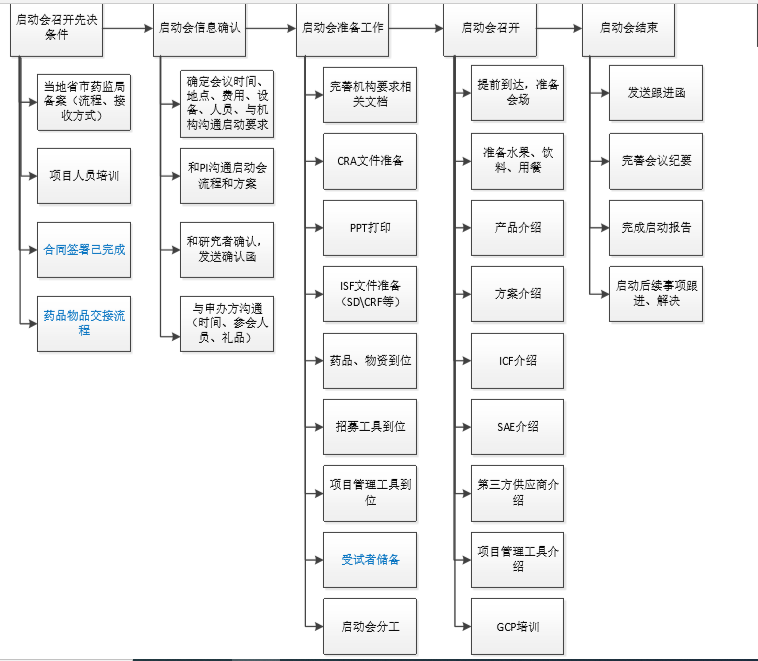
06 中心启动会
临床试验协议签署完成后,可以准备启动会的召开。Site启动前的一般要求:合同首款支付、试验物资及药品送达中心、遗传办备案完成。
完成site对于启动的要求,与site及PI确定启动会时间与流程,可以去中心召开启动会。
启动会的召开,代表可以在这个Site做项目啦。启动会需要提前准备,才能保证启动会当天顺利召开。
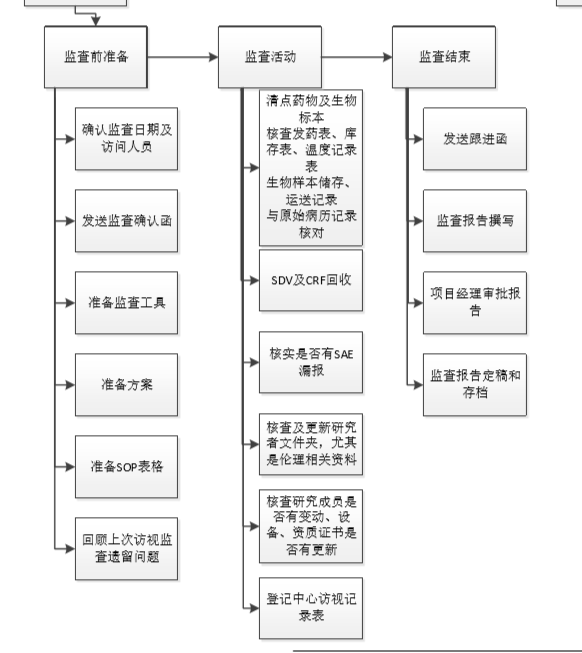
07 筛选入组/监查访视
启动会召开并完成试验人员的授权分工后,则可以去做筛选患者入组试验了。首例入组CRA必须到医院进行,第一例患者要确保中心按照方案要求去做,不然错误会一直延续。
筛选入组阶段,CRA可以做监查工作~希望每个项目都入组顺利
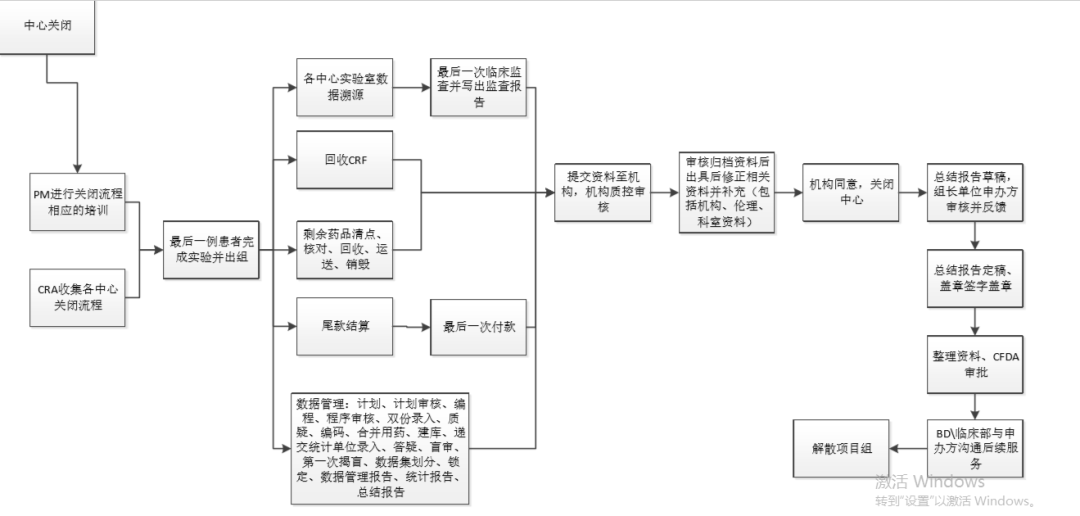
08 数据管理/中心关闭
走到这一步,恭喜你,项目即将结束。根据site的要求进行中心关闭,一般流程:伦理需要提交结题报告(结题报告审查形式根据医院要求,大多是快审),机构需要完成费用结算、质控及资料归档,科室那边物资、药品等清点回收。最后拿到分中心小结和总结报告签盖文件,该试验在这家site就彻底结束啦。
以上就是小编对临床试验的一些介绍,希望大家能够通过本文,更多的了解临床试验~