01 监 查
我们来看一下官方定义:《药物临床试验质量管理规范》(国家卫生健康委员会2020年第57号,2020年7月1日施行)在第二章第十一条(十三)监查,指监督临床试验的进展,并保证临床试验按照试验方案、标准操作规程和相关法律法规要求实施、记录和报告的行动。第二章(三十六)质量控制,指在临床试验质量保证系统中,为确证临床试验所有相关活动是否符合质量要求而实施的技术和活动。《医疗器械临床试验质量管理规范》(国家药品监督管理局2022年第28号,2022年5月1日施行)对监查有同样的定义,监查,是指申办者为保证医疗器械临床试验能够遵守临床试验方案、本规范和相关法律法规,选派专门人员对医疗器械临床试验机构、研究者进行评价调查,对医疗器械临床试验过程中的数据进行验证并记录和报告的活动。
监查作为质量控制的工具,是为了确保研究者和研究团队所有的行为和操作,遵循了GCP和临床试验方案、标准操作规程和相关法律法规要求,委派监查员是申办者职责之一,GCP也明确规定申办者可以授权CRO执行此部分职责。监查工作的首要任务是确保研究者对受试者的保护,知情同意及过程;确保临床试验的质量和进度也是非常重要的监查环节。通常监查团队汇报给申办者或者CRO临床运营负责人。
02 稽 查
我们来看一下官方定义:《药物临床试验质量管理规范》(国家卫生健康委员会2020年第57号,2020年7月1日施行)在第二章第十一条(十六)稽查,指对临床试验相关活动和文件进行系统的、独立的检查,以评估确定临床试验相关活动的实施、试验数据的记录、分析和报告是否符合试验方案、标准操作规程和相关法律法规的要求。(三十五)质量保证,指在临床试验中建立的有计划的系统性措施,以保证临床试验的实施和数据的生成、记录和报告均遵守试验方案和相关法律法规。《医疗器械临床试验质量管理规范》(国家药品监督管理局2022年第28号,2022年5月1日施行)对稽查有同样的定义,稽查,是指由申办者组织对医疗器械临床试验相关活动和文件进行系统性的独立检查,以确定此类活动的执行、数据的记录、分析和报告是否符合临床试验方案、本规范和相关法律法规。
稽查是质量保证的工具,也是申办者重要职责之一,申办者方也可以委托独立于试验以外的“第三方”实施稽查活动,然而,质量保证的终极目标是的质量体系持续的提高与改进;评估监查的质量控制工作是否遵循了GCP和体系中标准操作规程。试验中纠正预防措施及适宜的培训均为稽查后申办者的质量保证部门督促整改的一系列的工作。稽查团队往往汇报给申办者或者CRO的最高管理层。
03 检 查
我们来看一下官方定义:《药物临床试验质量管理规范》(国家卫生健康委员会2020年第57号,2020年7月1日施行)在第二章第十一条(十八)检查,药品监督管理部门对临床试验的有关文件、设施、记录和其他方面进行审核检查的行为,检查可以在试验现场、申办者或者合同研究组织所在地,以及药品监督管理部门认为必要的其他场所进行。《医疗器械临床试验质量管理规范》(国家药品监督管理局2022年第28号,2022年5月1日施行)对检查有同样的定义,检查,是指监管部门对医疗器械临床试验的有关文件、设施、记录和其他方面进行的监督管理活动。
从目的来看,检查的目的在于审核与检查临床试验的药品和器械数据的真实可靠性,是否保护了受试者权益,对有效性安全性的正确的统计分析,评估试验中患者是否风险最低,获益最大;保证产品上市后安全可靠,保护民众健康。
04 总 结
我们再次阐述一下,监查与稽查具体有何相同和不同?
相同:保证质量是临床试验中各方人员、申办者监查员、稽查员每个人的职责所在。
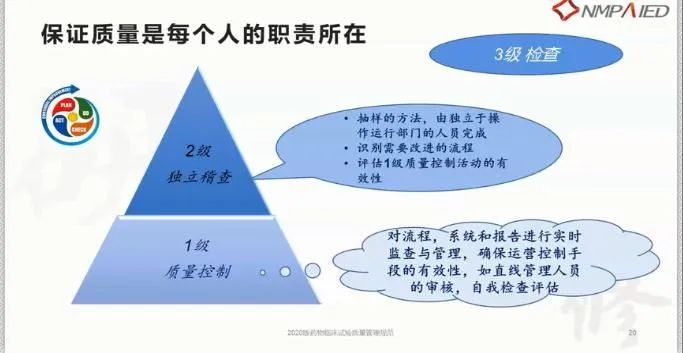
然而不同之处在于:监查是临床试验的第一级质量控制,由临床运营部门的监查员完成,对试验的流程、报告实施监查与管理,确保运营控制流程的有效性;稽查是临床试验质量的第二级的保证,由独立于临床运营团队以外的稽查员完成,不可以由监查员或临床运营团队人员兼任,任务是识别需要改进的流程,评估监查第一级质量控制活动的有效性。