01简介
恶性肿瘤是人类健康的一大杀手。大多数肿瘤预后较差、患者生存时间短、缺乏可治愈的手段。因此,抗肿瘤药物已成为当下创新药研发的热点。目前,早期肿瘤的临床试验大多都还依靠传统的设计方法。例如,在Ⅰ期的剂量探索试验中,“3+3设计”依旧是主要使用的方法。尽管该设计简单、容易实施,但统计性能较差,是导致研发成功率低下的原因之一。因此,开发创新的临床试验设计并将其逐渐推向临床应用是具有重要的现实意义的。
BOIN设计,全称是贝叶斯最优区间设计(Bayesian Optimal Interval design),是由美国德克萨斯大学MD Anderson癌症中心的袁鹰教授团队在2015年提出的一种I期临床试验剂量探索设计方法。BOIN设计作为一种新型的剂量探索方法,因其操作简单、理解容易、效能优越,在国内外受到了很多申办方和临研人的关注——我们的临床人体试验,不能像做动物试验一样,将许多的病人都分配到不同的剂量组中,再去观测第一个疗程后毒性的概率反应。我们只能序贯地进行,对数据进行不停地调整和更新。同时,考虑数据量很小,这也是在试验早期,尤其是Ⅰ期和Ⅱ期,适合采用贝叶斯方法的原因:贝叶斯方法天生地能够处理好小数据,而且能够根据我们现有的信息对已有的数据进行不断的更新。
由Ruitao Lin 教授等人提出的BOIN 12设计是BOIN设计在Ⅰ/Ⅱ期的另一种拓展。与之前分享的U-BOIN设计存在不同。BOIN 12是单阶段设计方案,整个设计和剂量探索都围绕着寻找OBD展开。与U-BOIN的异同将在本文末尾进行讨论。在BOIN 12下,患者被自适应地分配到最优治疗剂量,并在毒性和有效性之间进行最佳权衡。与现有的Ⅰ/Ⅱ期剂量发现设计(dose-finding designs)相比,BOIN 12设计更易于实施,识别OBD的准确性更高,并为OBD分配更多的患者。BOIN 12设计最吸引人的一个特点是,适应规则可以预先设定并包含在协议中。在试验过程中,临床医生可以通过查找可预先指定并包含在试验方案中的决策表,很容易地做出剂量升降的决定,而无需复杂的计算。
02设计原理[1]
BOIN 12通过效用进行毒性-有效性权衡,其值可由临床医生指定,以反映每个可能的毒性和有效性结果的临床期望值。假设毒性和有效性终点是二分类的,对于任意患者,有四种可能的结果:
1 =(无毒,有效)
2 =(无毒,无效)
3 =(有毒,有效)
4 =(有毒,无效)
设 u1,… ,u4 分别表示四种可能的毒性-有效性结果的效用值。我们将最理想的结果(无毒,有效)的效用设为 u1=100,将最不理想的结果(有毒,无效)的效用设为 u4=0,临床医生将这两个剂量的效用作为参考,指定其他两种结果 u2和u3的效用。给定特定剂量j ,令 p1,… ,p4分别表示在j处观察这些结果的概率,通常随剂量而变化。则剂量j的效用定义如下:
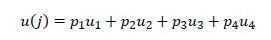
设 n(j) 表示在剂量j下治疗的患者数量,y1 (j),y2 (j),y3 (j),y4 (j)分别表示在剂量j下四种结果的患者数量。则有毒和有效的患者分别为nT (j)=y3 (j)+y4 (j)和nB (j)=y1 (j)+y3 (j)。
BOIN 12设计的决策基于u(j)的后验分布 f(u(j)| D(j)),其中D(j)=(n(j),y1 (j),y2 (j),y3 (j),y4 (j))表示在剂量水平j观察到的数据。BOIN 12基于拟似然理论直接对 u(j) 进行建模,定义标准化后的效用为 u* (j)= u(j) /100 ,因为u* (j)∈[0,1] 是(p1 (j),p2 (j),p3 (j),p4 (j))的加权平均,可以将其视为概率,并使用拟二项式数据(x(j),n(j)) 进行建模,其中
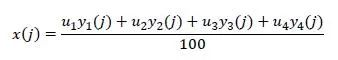
因此,观测数据 D(j) 的拟二项似然为
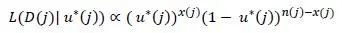
在贝叶斯框架下,假定先验 u(j) 服从贝塔分布,即
α,β~Beta(α,β)
其中,α和β是预设的超参数,一般设为α=β=1,即为无信息均匀分布先验。u* (j) 后验分布如下,
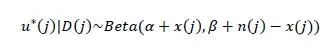
和大多数现有的Ⅰ-Ⅱ期设计不同,BOIN 12设计使用效用后验概率 Pr(u(j)>ub |D(j)) 来衡量和确定最优治疗剂量以治疗下一组患者。其中 ub 为效用阈值,由临床医生提前给出,反映了医生对药物疗效的期望。
由于使用拟似然理论,给定最大样本量,我们可以穷举可能出现的 D(j),并对 u* (j)的后验分布进行简单的计算和制表。为便于临床使用,BOIN 12设计将所有可能出现的 D(j)下的效用后验概率 Pr(u(j)>ub |D(j))从小到大排序,并从0, 1,…开始给他们赋值,得到的顺序值就称为基于秩的满意度指数(RDS)。由此,简化决策表的制定和使用。如下表1为 u2=40,u3=60 时对应的RDS决策表。满意度指数高的表示更优剂量。试验过程中,临床研究者无须进行复杂的计算,可以直接通过查找此决策表确定最优治疗剂量以治疗下一队列患者和实现剂量升降。
表1 BOIN 12的RDS决策表
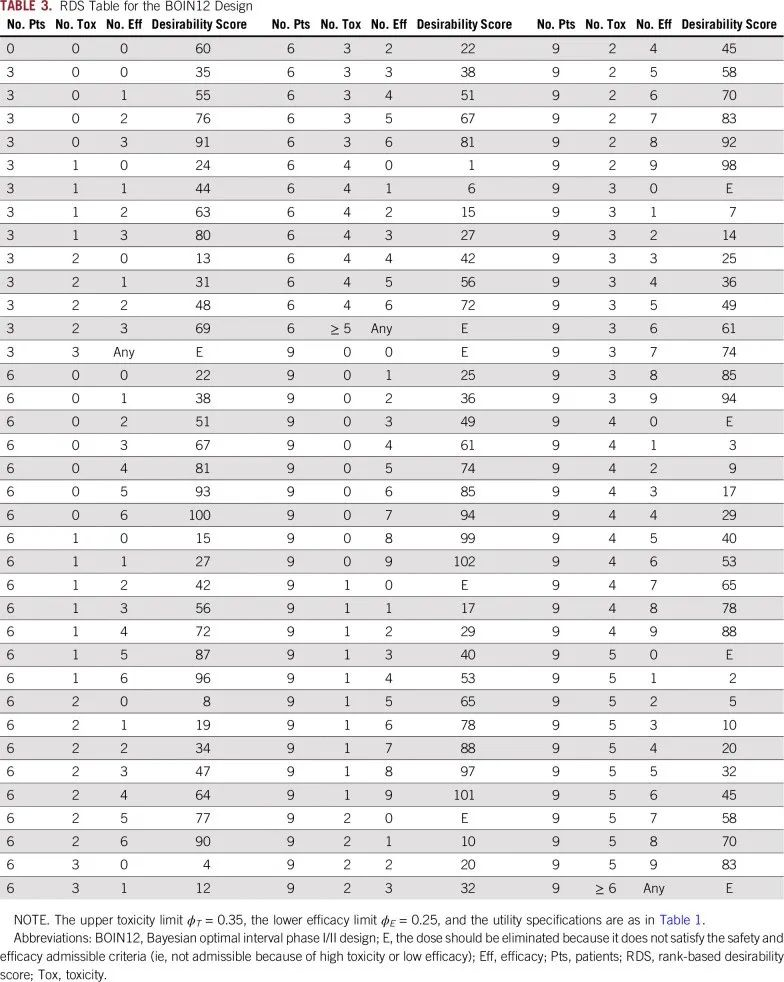
表格来源:参考文献[2]
为了保护患者免受有毒和无效剂量的影响,BOIN 12采用了两个剂量可接受性标准来决定哪些剂量可用于治疗患者。设 ϕT为可接受毒性率的上限,且 ϕE为可接受有效率的下限。这两个阈值都是由临床医生给定的。设 PT (j) 和 PE (j) 分别表示剂量j的毒性率和有效率。如果观察到的数据表明j是安全且有效的,cT和cE分别为概率阈值,则剂量j被定义为可接受的。在试验过程中,只有可接受的剂量可以分配至入组的患者进行试验,并剔除不可接受的剂量。如果所有剂量被剔除,则停止试验,不选择任何剂量作为OBD。
03剂量探索算法[1]
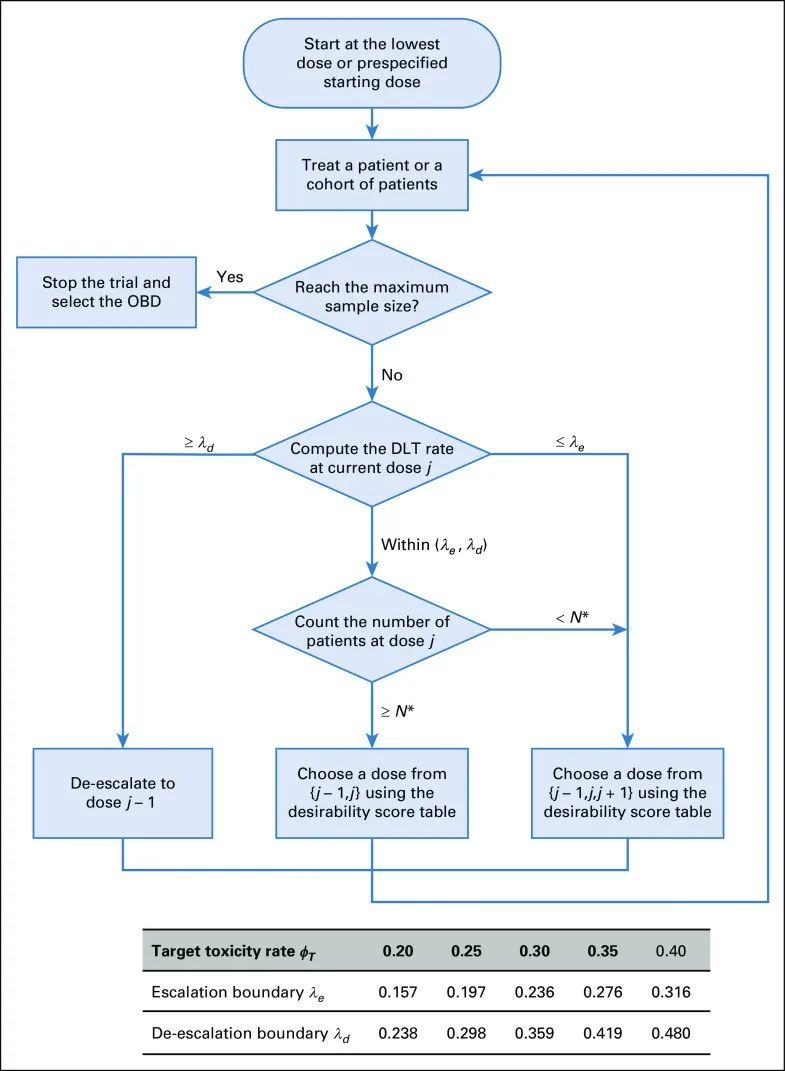
令P ̂T (j)=nT (j)/n(j)表示当前剂量所观察到的毒性率,λe和λd为BOIN设计中采用的最佳剂量递增和递减边界。设ub表示用于计算后验概率的效用阈值,N*是充分样本量的阈值。BOIN 12设计的剂量探索规则如下:
(1)以最低剂量或预先设定的剂量水平治疗第一组患者。
(2)假设当前剂量水平为j。
如果P ̂T (j)≥λd,那么下一队列患者的剂量水平降至 ( j-1)。
如果λe<P ̂T(j)<λd且n(j)≥N*,查找RDS决策表确定剂量j和( j-1)的满意度指数,并选择指数高的那个剂量入组下一队列。
如果P ̂T (j)≤λe,查找RDS决策表确定剂量j、( j-1)和( j+1)的满意度指数,并选择指数高的那个剂量入组下一队列。
表2 BOIN 12设计的剂量递增/递减边界
表格来源:参考文献[2]
(3)重复步骤2直至达到最大样本量。
当试验完成时,我们根据以下两步选择最终的OBD:首先,根据 ϕT选择MTD,任何高于MTD的剂量水平都被视为过毒。MTD可按如下确定:首先计算得每个剂量水平j下观察到的边际毒性率P ̂T (j)=nT (j)/n(j)后,通过PAVA算法对观察到的毒性率进行保序回归,然后选择最接近目标毒性率的剂量水平作为MTD:
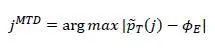
第二步,获得各剂量水平j下效用的后验均值如下,
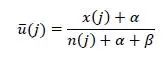
那么,不超过MTD且效用最大的剂量水平即为OBD:
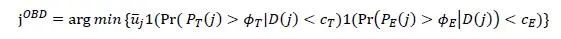
具体的流程图如下图1所示:
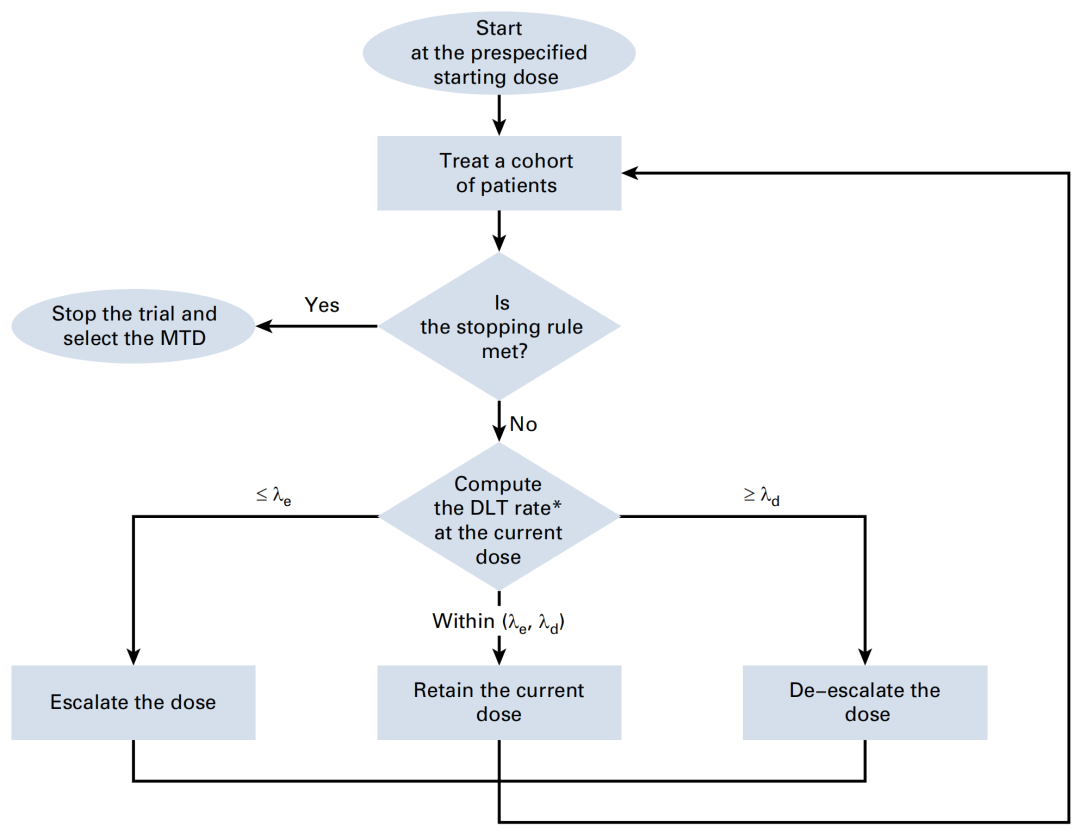
图1 BOIN 12设计的流程图
图片来源:参考文献[2]
04U-BOIN和BOIN12的异同[3]
这两个设计都将BOIN设计拓展到了Ⅰ/Ⅱ期临床试验,使用效用进行自适应随机化,其主要目的均为寻找OBD。它们的主要区别是U-BOIN对有序分类终点建立狄利克雷-多项式模型,采用两阶段设计方案,第一阶段着重于研究剂量的毒性以找到一个既安全又有效的可接受剂量集合,第二阶段着重于在此剂量集合中找到毒行-有效性权衡最优的剂量。两阶段设计方案的优点是易于与非统计研究人员解释沟通,此外其可以提供MTD(第一阶段)和OBD(第二阶段)双重信息。这对一些临床试验是重要的。早期临床试验往往同时关心毒性和有效性。BOIN 12设计则对加权效用建立贝塔-二项模型,采用单阶段设计方案,整个设计和剂量探索都围绕着寻找OBD展开。其优点是如果临床试验的目的是找到OBD,BOIN 12往往更高效、需要更少的样本量。作为模型辅助设计,U-BOIN和BOIN 12设计都兼有稳健、性能优良和操作简便的优点,它们为不同的Ⅰ/Ⅱ期临床试验提供了更全面的设计平台和工具。
05软件应用
目前,可通过袁鹰教授团队开发的网站进行BOIN 12设计:
https://www.trialdesign.org/one-page-shell.html#BOIN12
假设欲在恶性肿瘤实体患者中进行一项Phase Ⅰ/Ⅱ设计探索某试验药物的OBD:
剂量水平:5个(3,6,9,12和15mg/m2)
毒性结局:DLT发生率(toxicity with CTCAE grade 3 or higher)
疗效结局:二分类结局(肿瘤应答-完全缓解CR/部分缓解PR,稳定疾病状态SD/疾病进展PD)
剂量爬坡:样本量为30,设置10个队列,每个队列样本量设置为3,剂量爬坡从最低剂量开始试验
具体的操作步骤如下:
1. 首先,需要填写剂量数(Number of doses)、开始的剂量水平(Starting dose level)、队列大小(Cohort size)、队列数量(Number of cohorts)、如果当前剂量下的患者数量达到某定值则停止试验(Stop the trial if the number of patients at the current dose reaches)。如下图2所示。
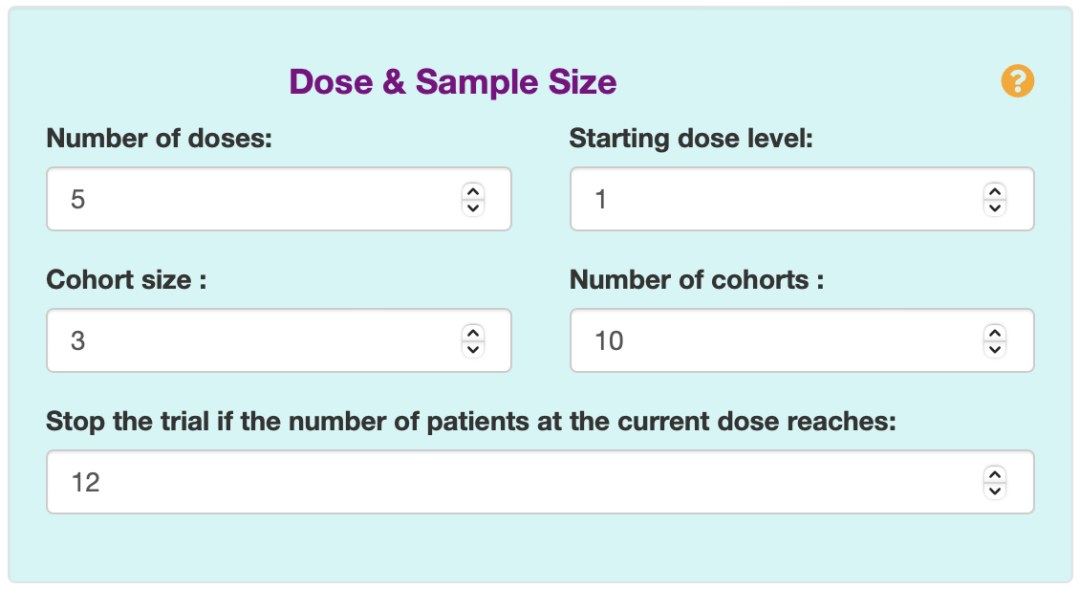
图2 Dose & Sample Size的填写
2. 选择剂量的风险-效益权衡。共有两种选择,第一种是使用效用来定义剂量的可取性,第二种选择则基于毒性-功效概率权衡函数 U=πE-wπT。此处选用第一种。经临床医学和统计等多方判断当出现疗效无应答但无发生DLT的情况并不理想,赋予其效用值u2=40;当出现疗效应答但发生DLT的情况尚可接受,赋予其效用值u3=60。效用表如下:
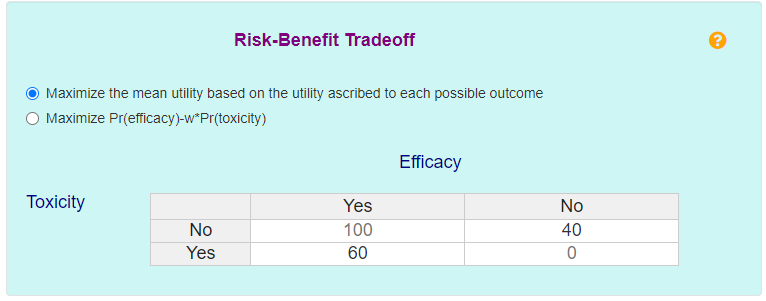
图3 风险-效益权衡效用表
3. 设置最大可忍受的毒性率(Upper limit for toxicity probability ϕT)和最小可接受的疗效应答率(Lower limit for efficacy probability ϕE),此处设置为 ϕT=0.35 和 ϕE=0.25。并设置判定为可接受剂量的毒性和疗效应答概率界值(通常设置为cT=0.95和cE=0.9)。
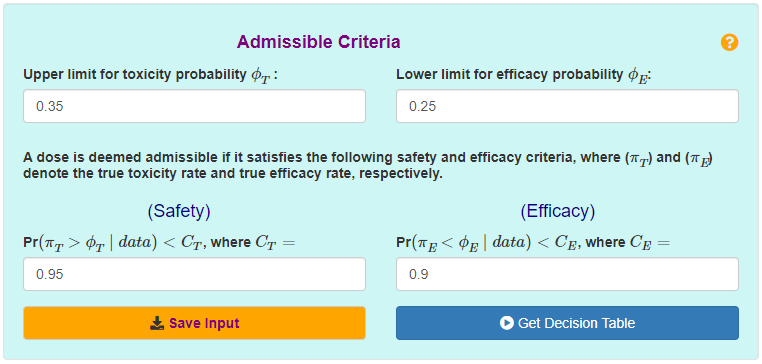
图4 容许标准
4.按下“Get Decision Table”键,网页右侧则会出现对应的升/降剂量边界表和RDS决策表,如下表3所示。
表3 BOIN 12设计的RDS决策表
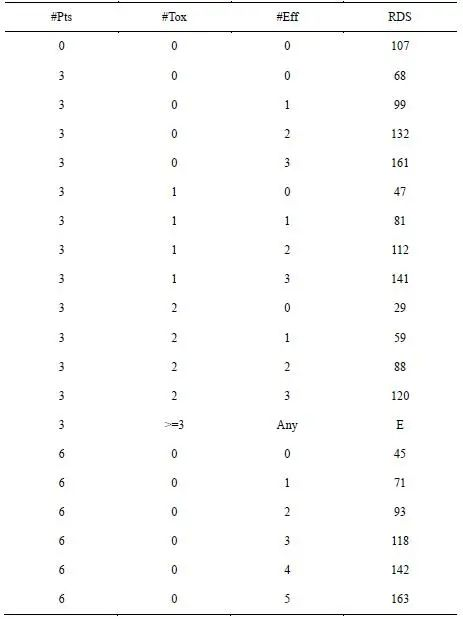
注:由于篇幅限制,本RDS决策表仅为完整表的一部分;“E”表示剂量由于过毒或无效而不可接受,应该被剔除。
在试验过程中,临床研究者无须进行复杂的计算,可以直接通过查找表3,确定最优治疗剂量以治疗下一队列以及实现剂量升降。例如,第一队列的3名患者在剂量水平1(3 mg/m2)下接受治疗,无人经历毒性或有效性事件。观测毒性率为0/3<λe=0.276。通过查询表3 可得,剂量水平1和2下的RDS分别为68(3,0,0)和107(0,0,0)。由于剂量水平2 的期望效用更高,提升剂量至水平2来治疗第二队列的3名患者。在第二队列观测到1次毒性和1次有效性事件,则根据剂量探索规则和期望效用表3,将剂量水平1,2,3的RDS更新为68(3,0,0)、81(3,1,1)和107(0,0,0)。由于剂量水平3的期望效用最高,提升剂量至水平3(9 mg/m2)来治疗第三队列。重复上述步骤,根据累计试验数据不断更新研究剂量的期望效用并作出剂量分配决策,直到达到最大样本量30。
5.根据累积试验数据不断更新研究剂量的期望效用并作出剂量分配决策,直到达到最大样本量。试验结束时,得到各个剂量治疗组的患者数 n(d),毒性数 nT (d),有效数nE (d),代入公式:
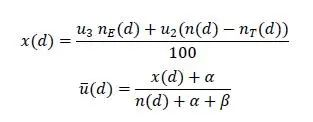
其中,u2和u3为临床医生对可能出现的毒性-有效性结果赋予的效用值;α和β为预设的超参数(一般设为α=β,即为无信息均匀分布先验)。计算可得各剂量下的最终估计期望效用,最大估计期望效用值对应的剂量水平则为OBD。
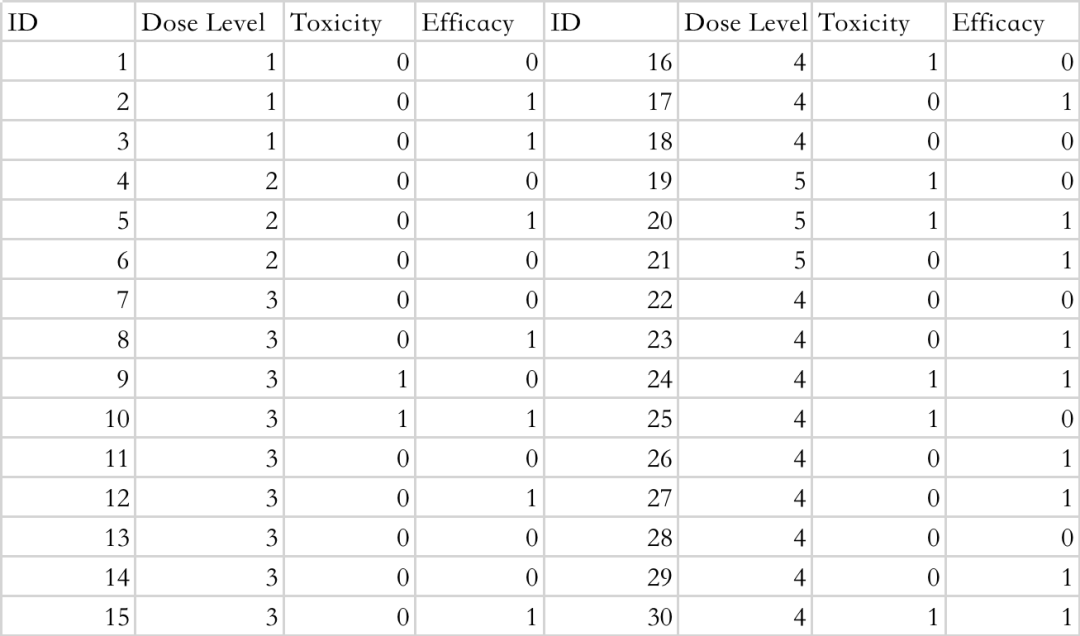
同样,袁鹰教授团队开发的该网站也可以帮助我们进行OBD的决策。如下表4是模拟的一次使用BOIN 12设计的临床试验中获取到的受试者数据。ID为受试者序列号,Dose Level为受试者接受的剂量水平,Toxicity为0和1分别代表未出现毒性事件和出现毒性事件,Efficacy为0和1分别代表未出现有效性事件和出现有效性事件。
表4 BOIN 12 设计下的模拟试验数据
将该数据导入网站中,与Trial Setting中的参数设置保持一致,点击“Estimate OBD”便可得到该试验数据下的OBD。
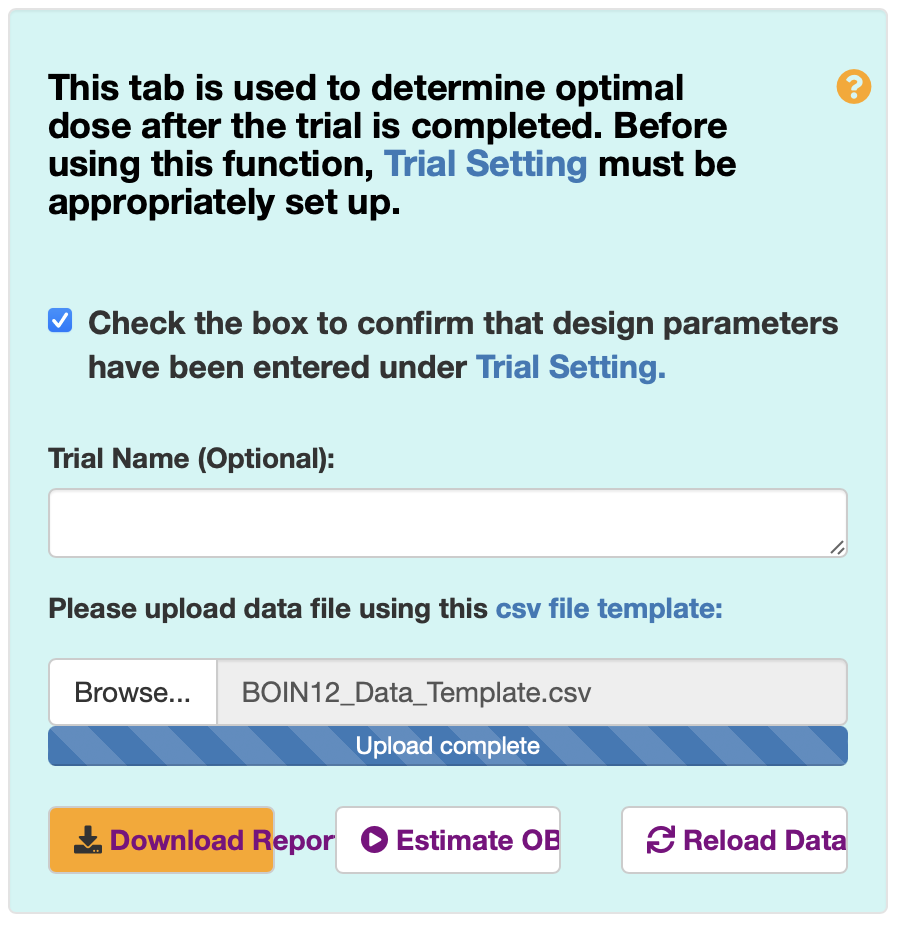
图5 估算OBD页面
该网站会返回各剂量组中受试者发生有效性事件和毒性事件的人数和相应的概率,如下图6和图7。并给出该试验数据下的OBD结果,如下图8。
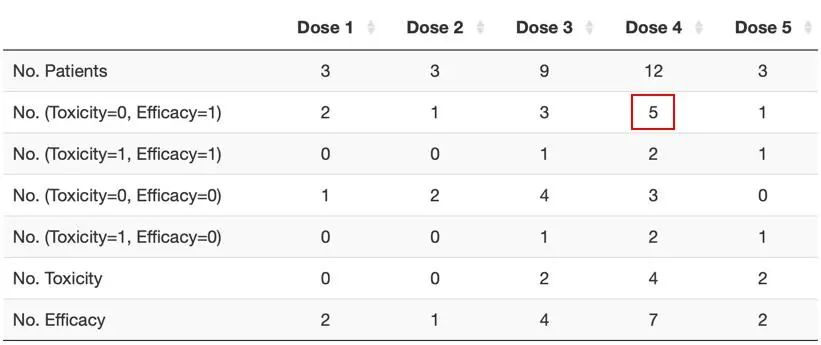
图6 发生有效性事件和毒性事件的人数汇总
如上图6,各行数据从上至下依次代表:
各剂量组的人数;
观测到有效性且无毒性事件的人数;
观测到有效性且有毒性事件的人数;
观测到无有效性且无毒性事件的人数;
观测到无有效性且有毒性事件的人数;
观测到出现毒性事件的人数;
观测到出现有效性事件的人数。
举例来说,图6中红框标记的数值5代表:在剂量水平4下,共有5人发生了有效性事件而未发生毒性事件。
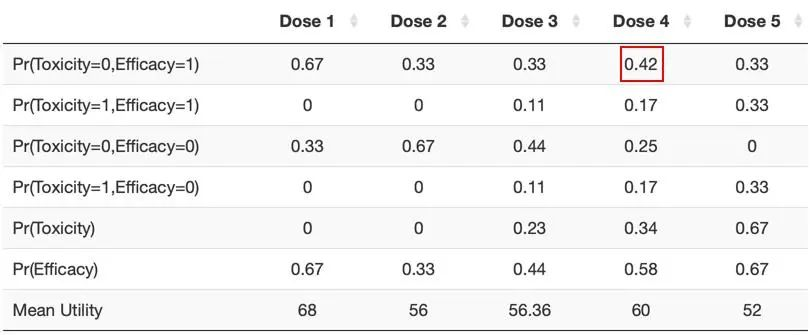
图7 发生有效性事件和毒性事件的概率汇总
如上图7,各行数据从上至下依次代表:
观测到有效性且无毒性事件的概率
观测到有效性且有毒性事件的概率;
观测到无有效性且无毒性事件的概率;