Part1
背景介绍
1.1
Ⅰ期临床试验的目的
l 确定最大耐受剂量(MTD):
Maximum Tolerated Dose,毒性概率最接近试验预先设定的目标毒性概率的剂量。
l 明确毒性相关定义
剂量限值毒性(Dose Limiting Toxicity, DLT):当药物引发的毒性与副作用达到一定程度,以至于病人无法在当前的剂量下继续接受治疗,此种程度的毒性反应称为DLT。DLT可参考以下三份文件或网页
NCI Common Toxicity Criteria (CTC 2.0), CTCAE v3.0 and 4.0
http://ctep.cancer.gov/reporting/ctc.html
WHO Common Toxicity Criteria
l 研究药代动力学和药效学
药代动力学(PK):人体对药物的作用
药效学(PD):药物对人体的作用
l 初步评估治疗的有效性
下图是一个典型的药物剂量与毒性的关系曲线,它清楚地显示了药物的毒性随着剂量的增加而单调上升。
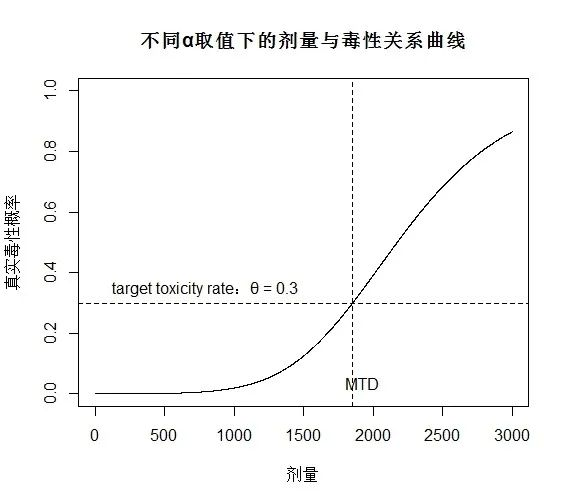
1.2
关键点
根据I期临床实验的目的,我们可以确定相关的关键点,包括满足入选排标的受试者人群,根据已有的信息确定起始剂量,通常如果是首次人体试验,最低剂量为动物试验所得LD10的1/10~1/3。根据药物特性定义剂量限值毒性(DLT)和评估,最大剂量的确定,递增剂量的选择,确定爬坡方案,爬坡终止条件,目标毒性概率等。
一般来说,为了安全起见,剂量组为由低到高逐渐增递增的序列,剂量的递增可以参考斐波那契数列,或者简单地将递增比例设为常量。
充分利用试验中收集的所有信息来准测地测定MTD,并尽量避免试验中将病人分配至过低或过高的药物剂量组。
1.3
常见设计方法
l 基于规则(Rule-based)的Ⅰ期试验设计
3+3设计 3+3 Design
加速滴定法
Rolling six
I3+3设计
控制过高剂量的非参数方法 Nonparametric Overdose Control(NOC)
l 基于模型(Model-based)的Ⅰ期试验设计
持续再评估方法 Continual Reassessment Method(CRM)
控制过高剂量的递增设计 Escalation With Overdose Control (EWOC)
基于贝叶斯模型的CRM Bayesian Model Average CRM (BMA-CRM)
稳健最优区间设计 Robust Optimal Interval(ROI)
l 模型辅助(Model-assisted design)的Ⅰ期试验设计
贝叶斯最优区间设计 Bayesian Optimal Interval(BOIN)
改良的毒性概率区间设计 Modified toxicity probability interval design (mTPI)
Keyboard设计
本文介绍的是最基础的单药无延迟毒性的药物I期临床试验,因此进行具体剂量探索方法的介绍之前,我们明确一些约定,其中包括两个假设:
(1) 药物的毒性随剂量的增加而单调递增
(2) 毒性反应无延迟效应,即由药物引发的毒性反应及副作用在接受治疗后短时间内发生
剂量探寻时应遵循以下两个原则:
(1) 逐步谨慎地推进试验,避免病人用药过度以保护其安全
(2) 快速地增加剂量,以避免将过多的病人分配至远低于MTD的无效剂量
接下来我们将详细介绍3+3设计、BOIN设计和CRM设计。
Part2
3+3设计
3+3设计是最常用也是最容易理解的Ⅰ期临床试验设计方法。其实施步骤如下图所示:
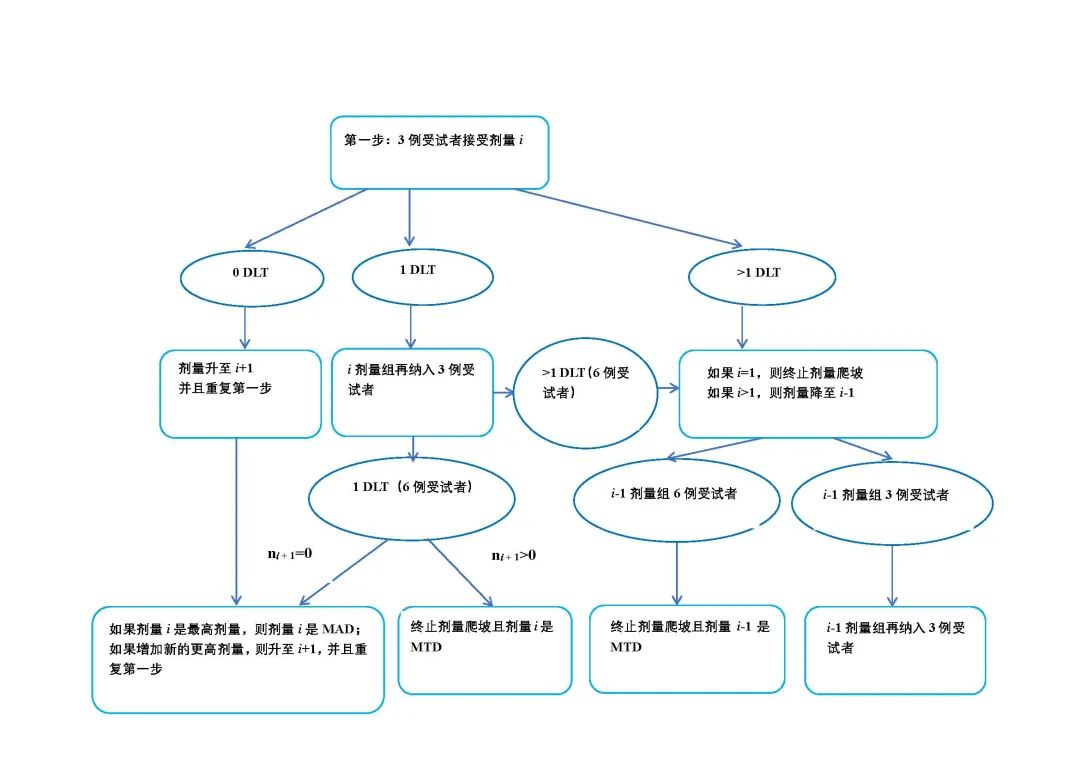
按录入时间三人为一组,以组为单位适应性的被分配至不同的药物剂量,通常新一组病人的剂量分配依赖于前一组病人中出现DLT的人数,如果一项试验包含了J个剂量组,那么试验设计所需的最大样本量为J*6。
3+3设计的优点为:操作便捷,简单明了,接受度好,比较流行;但其缺点也很明显:
信息使用不充分,仅使用当前剂量等级的病人信息;
不具有统计意义下的收敛性,仅适用于目标毒性概率低于33%(通常20%~30%)的试验,Lin and Shih, Biostatistics 2001
不够灵活,缺乏有效性
过多的受试者分配在低剂量下进行试验
为优化3+3设计,Storer 1989年提出二阶段3+3的设计方法,这种优化的方法可以加速试验的进程,并将剂量快速地提升至目标毒性区域。
第一阶段:以单个病人为单位依次逐步提升药物剂量,直到出现第一例DLT;
第二阶段:转至常规的3+3设计,确定MTD。
Part3
贝叶斯最优区间设计
3.1
方法
BOIN采用最优准则为最小化每一位受试者被分配到不恰当剂量上的概率来决定每批进入临床试验的受试者所应采用的剂量水平,因为这个准则针对的是每一位受试者,因此BOIN设计体现了个性化治疗的理念,且研究表明此方法可以确保试验的有效性,并最大可能地减少高剂量毒性水平下地受试者人数,因此一经推出,立即收到此领域学者和广大制药企业的关注。
BOIN设计剂量探寻步骤如下图所示:
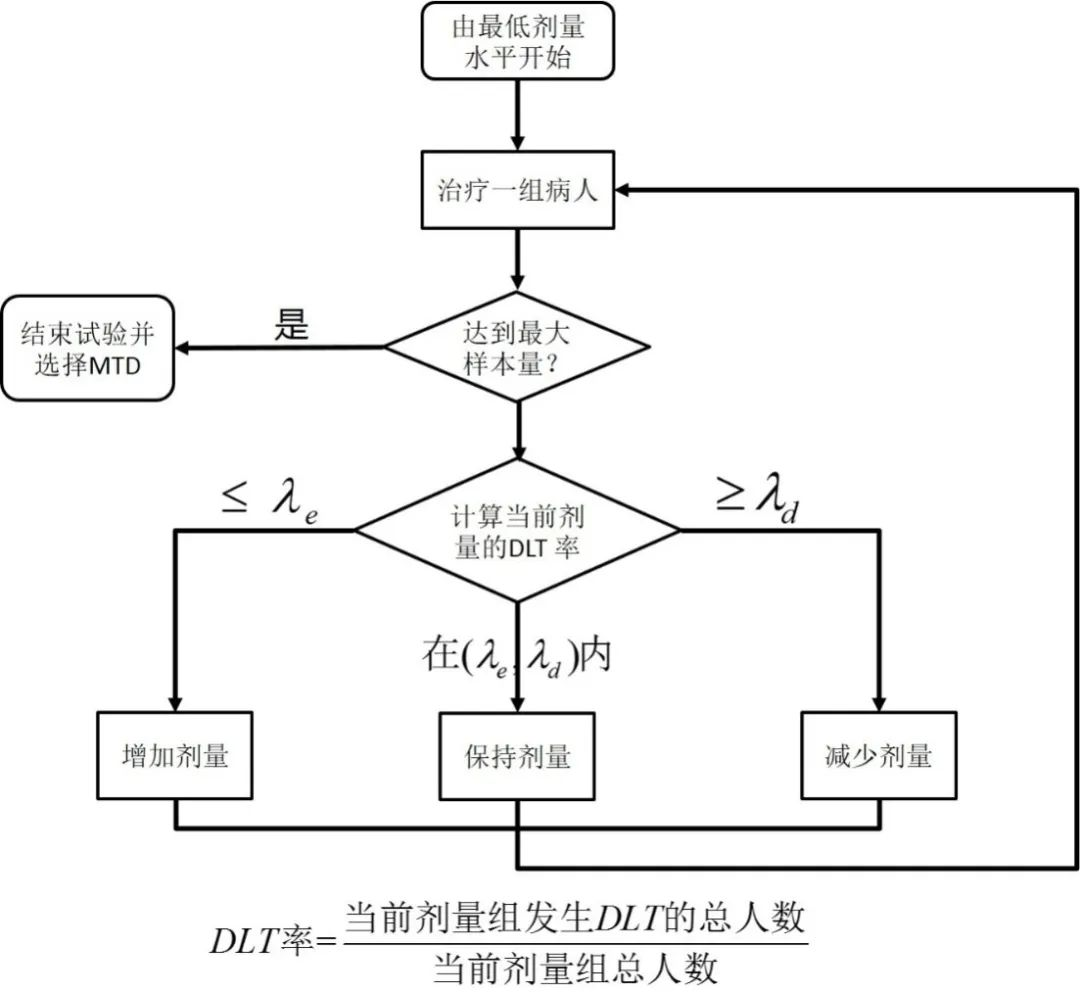
当达到所规定的最大样本量后,基于保序回归(isotonic regression),得到所有剂量的毒性估计,然后选择毒性估计最接近的pT剂量为MTD。
BOIN设计中剂量增减的决定取决于:
目前剂量水平的DLT发生率
剂量增减的边界值λe和λd
其中,λe,λd分别表示预先设定的剂量上升门限值(escalation)和剂量下降门限值(de-escalation),其中0≤λe≤ λd≤1。为了探寻门限值λe和λd,用户只需事先设定最低可容忍毒性概率ϕ1和最高可容忍毒性概率ϕ2。Liu(2015)推荐使用ϕ1=0.6pT和ϕ2=1.4pT,并提供λe和λd的显示解:
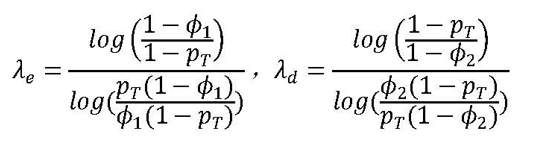
下表显示了常见的MTD靶水平的门限值λe和λd。
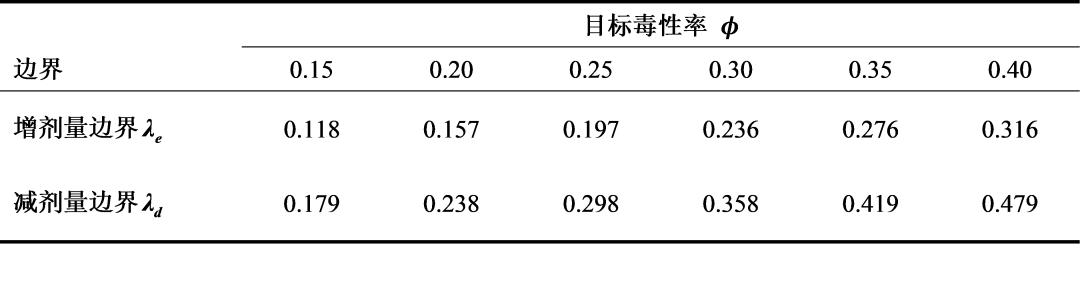
只需计算当前剂量 j 下毒性率的点估计p ̂j=yj/nj,再与边界进行比较即可方便地进行剂量升降决策。
3.2示例
某改良型抗体与不同化疗方案联合来治疗晚期实体瘤患者的I期临床试验,通过BOIN设计探寻该抗体的MTD。3个试验剂量水平,单次剂量分别为400mg、600mg、800mg。入组30例无标准治疗可用的实体瘤患者;以每组例数为3入组治疗;设定如果某一剂量水平总人数超过15人,则停止试验。目标毒性率ϕ=0.3;ϕ1=0.6ϕ=0.18,ϕ2=1.4ϕ=0.42,λe=0.236,λd=0.359。