在临床试验过程中,需要收集大量CRF外部数据。这些数据若不是作为主要的安全性或有效性的指标,则可被用作对受试者的筛选、常规安全性及生活质量的监测或是用作趋势分析。为了加快这些流程、减少不同试验方法和设备之间的差异,通常会采取选择集中供应商的实践。这类供应商可以将数据通过电脑传输至申办者的数据库,并可提供标准统一的核查和快速的结果,免去了不同研究中心之间正常值范围和标准不一致、数据传输错误以及录入错误等的影响。
《临床数据质量管理规范》(GCDMP)-临床数据管理学会,2013年10月版
引
作为临床试验过程中关键的一部分,外部数据一致性核查需要多方人员配合,且必须在锁库前完成。那么它的目的是什么呢?在实际操作过程中是怎样有条不紊进行的呢?
目 的
临床试验过程中,临床采集样本并交给外部供应商进行检测,但人工操作难免会造成EDC录入错误或数据传输错误(贴错标签)等,为了避免上述问题,数据管理人员作为主要负责人员,临床项目经理和外部供应商项目负责人作为辅助人员,进行外部数据的一致性核查是非常必要的。
一致性核查流程
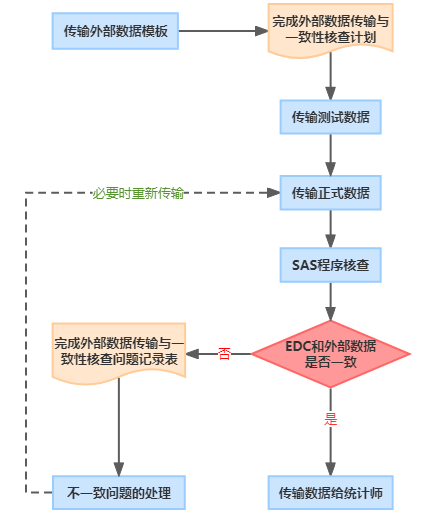
职 责
项目经理/CRA/CRC:收集受试者的相关信息及样本,并传递给外部供应商项目负责人,完成资料交接,配合完成一致性核查。
项目经理和/或外部供应商项目负责人:提供外部数据模板及测试/正式数据(计划中一般规定使用excel加密文件,发送2封邮件(1封外部数据+1封密码))、配合一致性核查。
DM撰写“外部数据传输与一致性核查计划”前,提供外部数据模板文件。
在正式数据传输前传输测试数据。
按计划要求定期传输正式数据。
根据CRF和外部数据模板撰写“外部数据传输与一致性核查计划”,最晚需在正式数据传输前签字定稿。
收到外部数据后通知SAS程序员生成外部数据一致性核查的疑问,核对后将存疑情况记录到问题记录表中并进行问题确认。锁库前形成终稿“外部数据一致性核查问题记录表”。
DM对计划、问题记录表和接收到的外部数据进行存档保存。
注意:在撰写“外部数据传输与一致性核查计划”时需和项目经理和/或外部供应商项目负责人确认在锁定前/揭盲前传输的数据是否存在盲态数据,如包含,需要非盲数据管理员进行数据的接收和/或进行一致性核查。
SAS程序员:根据定稿的“外部数据传输与一致性核查计划”撰写一致性核查程序,并经过程序内部审核,确保SAS核查程序正确。
一致性核查内容
核查内容:详细规定临床数据库(EDC)和外部数据清单中需要核查的所有内容,例如受试者编号、访视等,见表1:
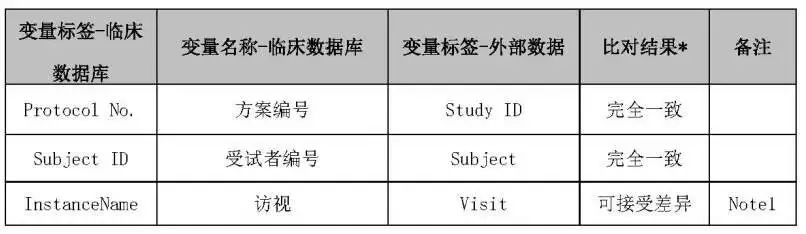
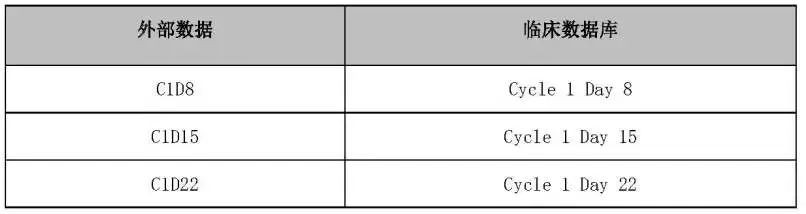
NOTE1:外部数据访视数据与临床数据库对应关系,见表2:
一致性核查结果:数据管理员负责生成外部数据与临床数据库一致性核查结果,并将不一致的内容记录在“外部数据一致性核查问题记录表”中。见表3
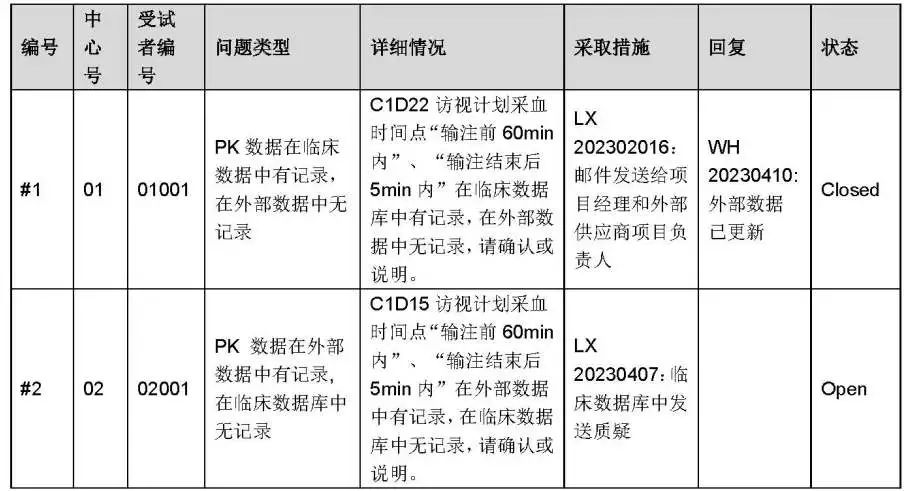
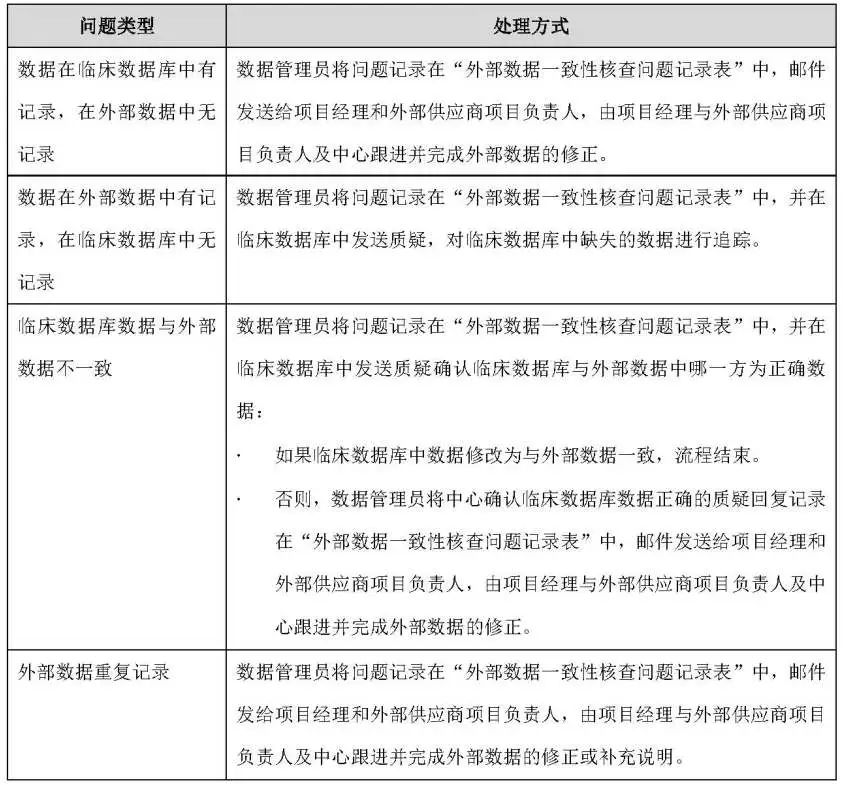
不一致问题的处理,见表4:
数据传输给统计师
数据管理员完成一致性核查,在数据锁定/揭盲后将数据传输给统计师。
结 语
数据管理员更像是整个外部数据管理的枢纽:接收并审核外部数据,通过一系列核查,最终交出更准确无误的数据。但外部数据一致性核查不只是数据管理员的工作,它在临床试验过程中无法取代,影响着临床试验的方方面面。
保证数据的规范性是临床试验的最低标准,是每个医药人的最终期望。