在开始今天讨论前,我们先分享一下上世纪的著名事件沙利度胺(反应停)。
1957年,联邦德国的格兰泰集团宣称“无任何毒副作用”,甚至使用了“孕妇的理想选择”的广告语,这款镇静剂的商品名就叫 “反应停”, 声称此药可以治疗晨吐、恶心等妊娠反应,并且没有任何副作用,在当时可谓是孕妇的福音。加拿大、非洲、拉美、日本、澳洲等大批购入“反应停”,而在有效地阻止怀孕早期孕吐的同时,它也阻碍了孕妇对胎儿的血液供应,导致大量“海豹畸形婴儿”出生。但是美国受到的影响最小,仅有的一百多名患者是因为服用了厂商提供的试用品。因为当时FDA负责审批的Kelsey医生驳回药厂的上市申请,反应停没有被获准在美国上市,那么Kelsey医生当时为什么会驳回药厂的上市申请呢?在1960年,美国Merrell公司获得了沙利度胺美国销售权,向FDA申请上市。当时才加入FDA三个月的Kelsey医生负责医学审查。当她看到该药是用于治疗孕妇晨吐和恶心等妊娠反应时,不禁想到曾经的一项研究表明一些药物存在通过胎盘屏障的可能,而这份材料中对孕期妇女使用后的毒副作用只字未提,因此她驳回了申请,要求提供详细的数据报告。后来FDA解密资料显示,Merrell公司锲而不舍,先后6次向FDA申请上市,全部遭到Kelsey医生的拒绝,作为一个新人,她承受了巨大的压力。1962年沙利度胺事件揭露后,Kelsey医生成为美国英雄,肯尼迪总统为其颁发了总统勋章。
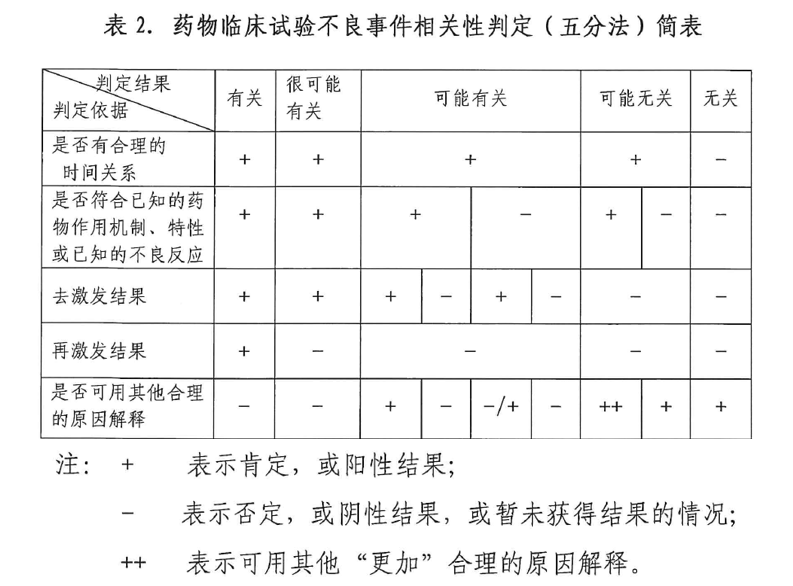
接下来我们再回顾一下相关概念及法规:临床试验中的安全性信息不良事件(adverse event,AE)、严重不良事件(serious adverse event,SAE)和可疑且非预期严重不良反应(suspected unexpected serious adverse reaction,SUSAR)。 1、AE:不良事件,指受试者接受试验用药品后出现的所有不良医学事件,可以表现为症状体征、疾病或者实验室检查异常,但不一定与试验用药品有因果关系。 2、SAE:严重不良事件,指受试者接受试验用药品后出现死亡、危及生命、永久或者严重的残疾或者功能丧失、受试者需要住院治疗或者延长住院时间,以及先天性异常或者出生缺陷等不良医学事件。 3、SUSAR:可疑且非预期严重不良反应,指临床表现的性质和严重程度超出了试验药物研究者手册、已上市药品的说明书或者产品特性摘要等已有资料信息的可疑并且非预期的严重不良反应。 根据《药品注册管理办法》第二十八条规定申办者应当定期在药品审评中心网站提交研发期间安全性更新报告。对于药物临床试验期间出现的可疑且非预期严重不良反应和其他潜在的严重安全性风险信息,申办者应当按照相关要求及时向药品审评中心报告。根据安全性风险严重程度,可以要求申办者采取调整药物临床试验方案、知情同意书、研究者手册等加强风险控制的措施,必要时可以要求申办者暂停或者终止药物临床试验。 根据《药物临床试验质量管理规范》第二十六条研究者的安全性报告应当符合以下要求:除试验方案或者其他文件(如研究者手册)中规定不需立即报告的严重不良事件外,研究者应当立即向申办者书面报告所有严重不良事件,随后应当及时提供详尽、书面的随访报告。严重不良事件报告和随访报告应当注明受试者在临床试验中的鉴认代码,而不是受试者的真实姓名、公民身份号码和住址等身份信息。试验方案中规定的、对安全性评价重要的不良事件和实验室异常值,应当按照试验方案的要求和时限向申办者报告。 研究者收到申办者提供的临床试验的相关安全性信息后应当及时签收阅读,并考虑受试者的治疗,是否进行相应调整,必要时尽早与受试者沟通,并应当向伦理委员会报告由申办方提供的可疑且非预期严重不良反应。 根据《国家药监局关于调整药物临床试验审批程序的公告》第十五条:申请人在获得首次临床试验许可后,应定期向药审中心提供药物研发期间安全性更新报告,包括全球研发和上市状况、正在进行中和已完成的临床试验、新增的安全性结果、重大生产变更、整体安全性评估、重要风险总结、获益-风险评估和下一年总体研究计划等内容。一般每年一次,于药物临床试验许可后每满一年后的二个月内提交。药审中心可以根据审查情况,要求申请人调整报告周期,逾期未提交的,申请人应暂停药物临床试验。 从反应停事件及相关法规,我们可以看出药物的安全性至关重要,而确保安全数据的准确性的重任,也就落在了我们CRA身上。 而评价药品安全性的主要方法就是收集不良事件,从I期到上市后药物警戒,持续的去收集不良事件,所以说不良事件的采集是伴随着药品全生命周期的。而针对不良事件的漏记/漏报,在各类形式的现场检查中,都会被100%的记录成问题/缺陷;若发生SAE的漏记/漏报,将会被记做重大问题/缺陷,甚至可能导致整个项目的不通过。 作为CRA需要注意哪些呢? 我认为主要有几个方面: 1、保证所有异常值,均经过研究者的判断,并留有签名和日期 2、保证临床意义的判定符合相关原则; 3、临床意义的判断标准尽量统一; 4、判断NCS时,尤其是发生的异常较正常值偏离较大时,应尽可能的备注理由; 5、对研究者及CRC做好培训工作。 针对不良事件收集的主要途径 1、检查单、化验单、护理单; 2、受试者日志卡; 3、受试者主诉; 4、调查问卷或量表,如生活质量问卷等; 5、一般体格检查 6、体重的变化(这点容易漏掉) 7、门诊/住院HIS的病程; 8、受试者的开药记录:门诊处方,住院医嘱,院外购买记录。 针对不良事件的记录核对 我们需要注意:AE名称、开始时间、严重程度、与药物相关性、是否采取措施、转归以及结束时间。 1、不良事件的名称应根据方案要求(目前一般是要求按照CTCAE5.0);若为CTCAE中未列出的AE,应使用规范的医学术语命名。 2、开始时间不同项目可能有不同要求,一般以“出现症状的时间”作为开始时间。 3、严重程度,一般方案要求参考CTCAE 1-5级分类。 4、与药物相关性,参考方案要求,一般为五分法:肯定有关、很可能有关、可能有关、可能无关、肯定无关;或者二分法:有关、无关;其中五分法具体可参考以下相关要求: (1)肯定有关:出现的临床不良事件(包括实验室检查异常)与研究药物给药存在合理的时间关联,并且,无法通过合并症或其他药物或化学制品进行解释。撤药(去激发试验)反应应当具有临床合理性。不良事件必须明确具有药理学或现象学特性,必要时使用符合要求的再激发试验程序; (2)很可能有关:与研究药物给药存在合理时间关联的临床不良事件(包括实验室检查异常),不太可能归因于合并症或其他药物或化学制品,遵循临床合理的撤药反应(去激发试验)。无需再激发试验信息来确定此定义; (3)可能有关:与研究药物给药存在合理时间关联的临床不良事件(包括实验室检查异常),并且,合并症或其他药物或化学制品同样可解释该临床不良事件的发生。可能缺乏或不清楚撤药信息; (4)可能无关:与研究药物给药存在时间关联的临床不良事件(包括实验室检查异常),缺乏去激发阳性证据以及缺乏再激发阳性证据,表现为不符合已知的作用机制、特性或已知的不良反应,且可以用其他合理解释的原因解释;或符合已知的作用机制、特性或已知的不良反应,但可以用其他更加合理的原因解释。 (5)无关:由于其他因素导致不良事件发生,如受试者的临床状况,其他治疗或伴随用药,不良事件与药物的使用无相关性。例如研究药物给药与发生不良事件之间没有合理的时间关联;研究药物与AE之间的因果关系看起来是极不可能的(例如受试者在交通意外中死亡或在回输前死亡)等。 CRA也要熟悉研究产品在既往研究过程中产生过的不良事件,熟知研究方案、研究者手册等项目文件中记录的研究产品的不良事件。在监查过程中,核实研究者是否存在漏记漏判AE,AE与药物相关性如果与既往数据记录存在偏差,及时与研究者进行沟通确认,并做好相关记录。 5、针对AE的采取的主要措施: (1)剂量不变:受试者在用药期间,发生了AE,但不改变原有的给药方案; (2)减少剂量:在用药期间因发生AE受试者需降低给药剂量; (3)暂停后恢复用药:因发生的AE受试者需暂停用药一段时间,且一段时间后又恢复用药; (4)停止用药:因发生的AE受试者永久停止服用试验药物。 6、针对AE转归主要有 (1)症状消失/痊愈; (2)缓解/好转; (3)持续/未好转; (4)加重; (5)恢复伴后遗症/痊愈有后遗症; (6)死亡。 7、针对AE的随访终点(参考方案要求) (1)出现转归:症状消失、缓解、加重、恢复伴后遗症、死亡; (2)不良事件恢复至基线状态; (3)不良事件趋于稳定状态,且研究者认为无需随访; (4)受试者失访或拒绝回访。(此条为针对AE无法确认,AE随访终点的原因) CRA在监查过程中也应监查AE转归的真实性和记录的准确性。 在今日分享的开头我们举了“反应停”这个例子,也是希望大家认识到不良事件的重要性。不良事件的准确记录对于受试者安全和临床试验的质量具有重大的影响,此次分享也是希望可以再次加深大家对不良事件认知和重视。作为CRA,我们的使命就是需要保证临床试验项目中的AE均被正确并且准确的记录。药品研发的革新与进步都需要干实事和下苦功的人推动,希望我们CRA在临床试验中都能严谨对待每一个不良事件,为药品安全性的提升推波助澜。
涉及死亡事件的报告,研究者应当向申办者和伦理委员会提供其他所需要的资料,如尸检报告和最终医学报告。